
| A. | 将煤干馏制得煤焦油和焦炭 | |
| B. | 从海水中可以得到氯化镁,再加热分解可制金属镁 | |
| C. | 将石油裂解制得乙烯等化工原料 | |
| D. | 煤的气化主要反应是C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g) |
分析 A、煤干馏的产品有焦炉气、煤焦油和粗氨水、焦炭等;
B、根据金属镁的冶炼来分析;
C、石油裂解的主要目的是获得乙烯;
D、将煤在高温条件下和水蒸气反应生成CO和氢气的反应为煤的气化.
解答 解:A、煤干馏的产品有焦炉气、煤焦油和粗氨水、焦炭等,即煤焦油和焦炭是煤的干馏的产品,故A正确;
B、从海水中可以得到氯化镁,但需电解熔融的氯化镁才能制得金属镁,故B错误;
C、石油裂解的主要目的是获得乙烯,乙烯是一种重要的化工原料,故C正确;
D、将煤在高温条件下和水蒸气反应生成CO和氢气的反应为煤的气化,反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g),故D正确.
故选B.
点评 本题考查了煤和石油的综合利用以及金属的冶炼,难度不大,应注意的是电解熔融氯化镁来冶炼镁,电解熔融的氧化铝来冶炼金属铝.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O、D2O、HD均是化合物 | B. | 碱性氧化物均是金属氧化物 | ||
| C. | 能与NaOH溶液反应的盐均是酸式盐 | D. | CCl4、酒精、氯气均是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3:6 | B. | 6:3:2 | C. | 1:2:3 | D. | 3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子得失电子能力与该原子最外层电子数多少有关 | |
| B. | ⅠA族、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布 | |
| C. | ⅦA族元素的原子随核电荷数的增加,得电子能力逐渐减弱 | |
| D. | 前三周期元素中共有非金属元素12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述过程中,最终被还原的是NO3- | |
| B. | 从上述过程中可以得出结论,氧化性:HNO3>Fe3+>稀H2SO4 | |
| C. | 假设通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积为1:1 | |
| D. | 上述过程中,会产生一种无色的难溶于水的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
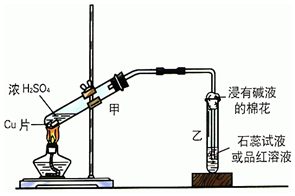 实验室常用如图装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用如图装置来进行铜跟浓硫酸反应等一系列实验.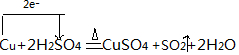
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含H+的溶液 | |
| B. | pH<7的溶液 | |
| C. | c(OH-)<c(H+)的溶液 | |
| D. | 25℃时,由水电离出来的c(H+)=1×10-9mol/L的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com