
| X | Y | Z |
| W | ||
| T |
| A. | 单质X2与Y2在放电作用下不能直接反应得到XY2 | |
| B. | X2Y2易溶于H2Y是由于它们分子间存在氢键的缘故 | |
| C. | 非金属性:Z元素比W元素强;酸性:HZ比HW强 | |
| D. | TY2既具有氧化性,也具有还原性 |
分析 X、Y、Z、W为短周期元素,X的氢化物与其最高价氧化物的水化物能直接反应生成盐,则X为N元素;由元素相等位置可知,Y为O元素,Z为F元素,W为Cl,T为Se,结合元素周期律与元素化合物知识解答.
解答 解:X、Y、Z、W为短周期元素,X的氢化物与其最高价氧化物的水化物能直接反应生成盐,则X为N元素;由元素相等位置可知,Y为O元素,Z为F元素,W为Cl,T为Se.
A.单质N2与O2在放电作用下反应生成NO,故A正确;
B.N2O2中O元素能与H2O中H原子之间形成氢键,增大物质的溶解性,故B正确;
C.HF为弱酸,而HCl为强酸,故C错误;
D.SeO2中Se元素为+4价,与二氧化硫性质相似,既具有氧化性,也具有还原性,故D正确.
故选:C.
点评 本题考查结构性质位置关系应用,熟练掌握元素周期表的结构,注意对元素周期律的理解以及氢键对物质性质的影响.


科目:高中化学 来源: 题型:选择题
| A. | 该溶液中H+、Fe2+、C6H5OH、Br-可以大量共存 | |
| B. | 该溶液中滴入含0.1molNa0H的稀溶液的离子方程式为:3NH${\;}_{4}^{+}$+Fe3++6OH-═Fe(0H)3↓+3NH3↑+3H2O | |
| C. | 该溶液中加入足量Zn粉的离子方程式为:2Fe3++Zn═Zn2++2Fe2+ | |
| D. | 该溶液中加1L0.2mol/L Ba(0H)2溶液的离子方程式为:NH${\;}_{4}^{+}$+Fe3++2S0${\;}_{4}^{2-}$+2Ba2++4OH-═2BaSO4↓+Fe(OH)3↓+NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有6.5 g锌被腐蚀 | B. | 有22.4 L氢气放出 | ||
| C. | 有2.8 g铁被腐蚀 | D. | 有2.24 L氢气放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1mol•L-1的弱酸HX的电离度为0.3%,2.0mol•L-1的弱酸HY的电离度为0.5%,由此可知HX比HY弱 | |
| B. | 物质的量浓度相同的H2SO4、NaOH溶液,分别从室温加热到80℃(假设不考虑水的蒸发),溶液的pH均不变 | |
| C. | 由于I2(aq)+I-(aq)?I3-(aq),所以碘单质在KI溶液中的溶解度比在纯水中的大,依此类推Cl2在一定浓度的NaCl溶液中溶解度也比纯水中的大 | |
| D. | 浓度均为0.1mol•L-1的NaClO、NaHCO3溶液的pH分别为10.3和9.7,可说明水解能力HCO3->ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Al、Ga均处于ⅢA族 | B. | Ga2O3可与盐酸反应生成GaCl3 | ||
| C. | Ga(OH)3可与NaOH溶液生成NaGaO2 | D. | 酸性:Al(OH)3>Ga(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:填空题
某溶液中只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-、CO32-。当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示。该淡黄色物质做焰色反应实验显黄色。
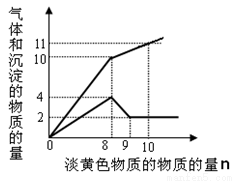
可知溶液中含有的离子是 ;
所含离子的物质的量浓度之比为____________ _;
所加的淡黄色固体是_______________ _。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com