
| A. | 金属氧化物 | B. | 强碱 | C. | 单质 | D. | 正盐 |
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
 的原子数目为NA.
的原子数目为NA.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
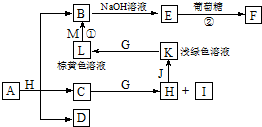 各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.
各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
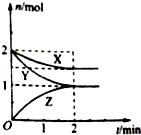 在容积固定的2L密闭容器中,一定条件下发生如下反应:X(g)+2Y(g)?nZ(g),反应过程中各物质的量与时间的关系如图所示.完成下列填空:
在容积固定的2L密闭容器中,一定条件下发生如下反应:X(g)+2Y(g)?nZ(g),反应过程中各物质的量与时间的关系如图所示.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.配制0.10mol•L-1溶液 | B.除去CO中的CO2 | C.苯萃取碘水中I2,分出水层后的操作 | D.记录滴定终点读数为12.20mL |
 | 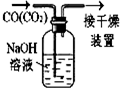 |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com