
| A. | 第二个反应的平衡常数为1 | |
| B. | 第二个反应的平衡常数为0.05 | |
| C. | 第二个反应达到平衡时,H2的平衡浓度为0.25mol/L | |
| D. | 第二个反应达到平衡时,HI(g)的平衡浓度为0.25 mol/L |
分析 一定温度下,将H2和I2各1mol的气态混合物充入1L的密闭容器中,充分反应,达到平衡后生成的HI(g)的气体体积的50%,设转化的氢气为xmol,依据化学平衡三段式列式为:
H2 +I2 ?2HI
起始量(mol/L) 1 1 0
变化量(mol/L) x x 2x
平衡量(mol/L) 1-x 1-x 2x
HI(g)的气体体积的50%,则$\frac{2x}{1-x+1-x+2x}$=50%,解得x=0.5mol
故K=$\frac{1{\;}^{2}}{0.5×0.5}$=4,
该温度下,在另一个容积为2L的密闭容器中充入1mol HI(g)发生反应HI(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g),等效为充入H2和I2各0.5mol,又该反应为气体体积不变得反应故与原平衡成比例等效,则新平衡时氢气为0.5mol×$\frac{1}{2}$=0.25mol,HI(g)为1mol×$\frac{1}{2}$=0.5mol,以此解答该题.
解答 解:A、B.根据平衡常数只与温度有关,结合正反应与逆反应的平衡常数成倒数关系,故 2HI?H2 +I2的平衡常数为$\frac{1}{4}$,又同一反应平衡常数与系数成幂次方关系,故后一反应的平衡常数为$\sqrt{\frac{1}{4}}$=0.5,故A、B错误;
C.根据以上计算第二个反应达到平衡时,H2的平衡浓度为$\frac{0.25mol}{2L}$=0.125mol/L,故C错误;
D.由以上计算后第二反应达到平衡时,HI(g)的平衡浓度为$\frac{0.5mol}{2L}$=0.25mol/L,故D正确.
故选D.
点评 本题考查了化学平衡的三段式计算应用,为高考常见题型,侧重于学生的分析能力和计算能力的考查,平衡常数与方程式之间的关系以及等效平衡的判断是本题的关键,题目较简单.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
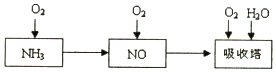
 氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).
氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| I | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 夏天打开啤酒盖,喷出大量泡沫 | |
| B. | 工业上合成氨气时采用高温利于氨气的合成 | |
| C. | 在HI的分解实验达到平衡后加压颜色变深 | |
| D. | 锌和稀硫酸制备氢气时滴入少量硫酸铜可以加快速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
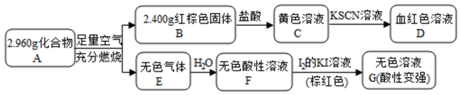
 . 该反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑.
. 该反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量铁在1molCl2中燃烧时转移电子数为2NA | |
| B. | 2L0.1mol•L-1氯化钾溶液中阴离子所带电荷数为NA | |
| C. | 1L0.1mol•L-1的Na2CO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| D. | 标准状况下,体积各为2.24L的HCl和NH3混合气体中含有的共价键数为0.25NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com