
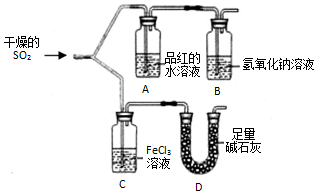
 如图装置进行SO2气体性质实验.
如图装置进行SO2气体性质实验.分析 二氧化硫具有漂白性,可使品红褪色,为酸性氧化物,可与氢氧化钠溶液反应,具有还原性,可与氯化铁发生氧化还原反应,以此解答该题.
解答 解:(1)依据形状可知:装置D中盛放碱石灰的仪器名称干燥管;
故答案为:干燥管;
(2)二氧化硫具漂白性,能使品红溶液褪色,A中盛放的是品红溶液,所以仪器A中的实验现象是品红溶液褪色;
故答案为:品红溶液褪色;
(3)二氧化硫具有还原性能被铁离子氧化为硫酸根离子和亚铁离子,则将SO2气体通入FeCl3溶液中的离子反应为2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+,
故答案为:2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
点评 本题考查了二氧化硫的实验室制备及性质检验,为高频考点,侧重于学生的分析能力和实验能力的考查,明确制备原理及二氧化硫性质是解题关键,题目难度不大.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl2、Br2、I2的沸点逐渐升高,是因为分子间作用力越来越大 | |
| B. | NaOH和NH4Cl化学键类型相同 | |
| C. | N2和CCl4两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 石英晶体是原子晶体,其分子式为SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果设“此”为电解质,“彼”为非电解质,不是所有的物质都是非此即彼的 | |
| B. | 不是所有反应,都遵循由强(如强酸、强碱、强氧化剂或强还原剂等)制弱(如弱酸、弱碱、弱氧化剂 或弱还原剂等)的规律 | |
| C. | 不是所有自发进行的反应都一定是焓减少的过程 | |
| D. | 在迄今发现的元素中,不一定所有非金属元素(稀有气体除外)都满足条件“主族元素的族序数≥其周期序数” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg3N2晶体中的化学键是共价键 | |
| B. | 某物质含有离子键,则该物质在任何条件下均能导电 | |
| C. | 干冰是分子晶体,其气化过程中只需克服分子间作用力 | |
| D. | 常温常压下,气态单质分子中,每个原子的最外层都具有8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项[来 | 实验 | 现象 | 结论 |
| A | 常温下,等量等表面积的Al片分别和等体积稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
| B | FeCl3溶液用于刻蚀铜制印刷电路板 | 溶液变蓝 | 氧化性:Cu2+>Fe2+ |
| C | 向FeCl2溶液中加入足量Na2O2粉末 | 出现红褐色沉淀和无色气体 | FeCl2溶液部分变质 |
| D | 向足量含淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的蔗糖溶液 | B. | 0.1mol/L的CaCl2溶液 | ||
| C. | 0.2mol/L的NaCl溶液 | D. | 0.1mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  操作I导致配制溶液的物质的量浓度偏小 | |
| B. |  用装置II干燥氨气 | |
| C. |  实验Ⅲ可观察铁钉的吸氧腐蚀 | |
| D. |  实验Ⅳ记录的读数为12.20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2只作氧化剂 | |
| B. | 2 mol FeSO4发生反应时,反应中共有8 mol电子转移 | |
| C. | 每生成16g氧气就有1mol Fe2+ 被还原 | |
| D. | Na2FeO4既是还原产物又是氧化产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com