
| A. | 乙醇溶液 | B. | 氨化钠溶液 | C. | 盐酸 | D. | 氢氧化铁胶体 |
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
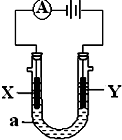 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
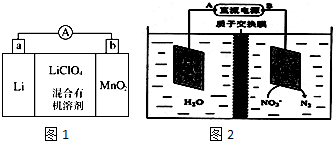
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
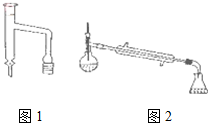 乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下: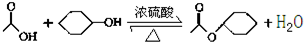
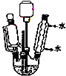 | 相对分子质量 | 密度/g•cm-3 | 沸点 | 水中溶解性 | |
| 乙酸 | 60 | 1.051 | 118.0 | 溶 | |
| 环己醇 | 100 | 0.962 | 160.8 | 微溶 | |
| 乙酸环己酯 | 142 | 0.969 | 173.5 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠能与硫酸铜稀溶液反应,置换出红色的铜 | |
| B. | 为了消除碘缺乏病,在食用盐中必须加入一定量的单质碘 | |
| C. | 过氧化钠是淡黄色固体,可用作呼吸面具的供氧剂 | |
| D. | 氢气在氧气或氯气中燃烧,都能观察到淡蓝色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H6O的有机化合物性质相同 | |
| B. | 现在“点石成金”术石墨变成金刚石属于物理变化 | |
| C. | 过氧化钠与水反应成1mol氧气转移4mol电子 | |
| D. | 工业上冶炼铝时加入冰晶石的作用是降低氧化铝的熔融温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取样,加氯水和CCl4,振荡、静置 | |
| B. | 取样,加足量的NaOH浓溶液,加热,用湿润的红色石蕊试纸检验气体 | |
| C. | 取样,加足量盐酸加热,用湿润的品红试纸检验气体 | |
| D. | 取样,滴加硫氰化钾溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com