
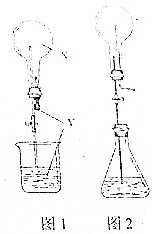
 关于喷泉实验,回答下列问题:
关于喷泉实验,回答下列问题:分析 (1)打开止水夹,将滴管中的水挤入圆底烧瓶中,氯化氢极易溶于水,使烧瓶中压强迅速减小,在外界大气压的作用下,烧杯中的水,被压入圆底烧瓶中;氯化氢溶于水生成盐酸,盐酸中含有氢离子,显酸性能够使石蕊变红色,产生红色的喷泉现象;
喷泉实验的关键是瓶干燥;装置气密性良好;收集的气体纯净、足量,否则不会产生喷泉实验或者喷泉停止后,液体没有充满烧瓶;
当气体能与液体反应时,造成烧瓶内部压强变小,导致烧瓶内外产生压强差而形成喷泉,依据溶液中所含物质判断喷泉的颜色;
(2)锥形瓶内装有酒精,易挥发,要形成喷泉,应使锥形瓶内压强增大,所加物质应放出大量的热,以此解答.
解答 解:(1)引发喷泉的实验操作是:打开止水夹,将滴管中的水挤入圆底烧瓶中;
喷泉产生原因:氯化氢极易溶于水,使烧瓶中压强迅速减小,在外界大气压的作用下,烧杯中的水,被压入圆底烧瓶中;
氯化氢溶于水生成盐酸,盐酸中氯化氢电离产生氢离子,电离方程式:HCl=H++Cl-,显酸性能够使石蕊变红色,产生红色的喷泉现象;
若喷泉停止后,液体没有充满烧瓶,可能的原因是:收集的氯化氢不纯或者装置漏气;
A.氯化氢易溶于水,能够形成喷泉,但是氯化氢为酸性气体,遇到酚酞不变色,所以不能产生白色沉淀,故A不选;
B.氯化氢易溶于水,能够形成喷泉,但是氯化氢为酸性气体,遇到石蕊变红色,能够形成红色喷泉,不能产生白色沉淀,故B不选;
C.一氧化碳不溶于水,所以一氧化碳和氢氧化钠不能形成喷泉实验,故C不选;
D.氯化氢易溶于水,能够形成喷泉,氯化氢与硝酸银反应生成氯化银白色沉淀,所以会产生白色喷泉实验,故D选;
故答案为:打开止水夹,将滴管中的水挤入圆底烧瓶中;HCl=H++Cl-;氯化氢极易溶于水,使烧瓶内压强迅速减小;收集的氯化氢不纯或者装置漏气;D;
(2)浓硫酸遇水被稀释,释放出大量的热,使锥形瓶中的乙醇挥发,压强增大,形成喷泉,而其它物质都不能达到溶于水而放出大量的热的目的,故选A;
产生喷泉的原因是:浓硫酸遇水被稀释,释放出大量的热,使锥形瓶中的乙醇挥发,压强增大;
故答案为:A;浓硫酸遇水被稀释,释放出大量的热,使锥形瓶中的乙醇挥发,压强增大.
点评 本题以气体的化学性质为载体考查了喷泉实验,明确喷泉实验的原理和物质的性质是解题关键,题目难度不大.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | HC≡CH+HCl$\stackrel{催化剂}{→}$H2C=CHCl | |
| B. | C 2H5OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O | |
| C. | CH4+2O2 $\stackrel{点燃}{→}$ CO2+2H2O | |
| D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80g | B. | 160g | C. | 98g | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol Fe与足量的盐酸反应 | B. | 0.4mol Cu投入到足量的稀硫酸中 | ||
| C. | 0.1mol Al与足量的NaOH溶液反应 | D. | 0.1mol Fe与足量的水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原铁和铝的物质的量相等 | |
| B. | 原盐酸的浓度为2mol•L-1 | |
| C. | 铁加入盐酸中的离子方程式为2Fe+6H+=2Fe3++3H2↑ | |
| D. | 盐酸与氢氧化钠溶液的物质的量浓度之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知水在25℃和95℃时的电离平衡曲线如下图所示:
已知水在25℃和95℃时的电离平衡曲线如下图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:X2R>X2Y | |
| B. | WY2能与碱反应,但不能与任何酸反应 | |
| C. | Z位于第三周期第ⅢA族,Z与Y形成的化合物是一种比较好的耐火材料 | |
| D. | 使甲基橙变红色的溶液中:K+、R2-、ZY2-、WY32- 一定能大量共存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com