
���� ��1����֪����2Cu��s��+$\frac{1}{2}$O2��g��=Cu2O��s������H=-169kJ•mol-1��
��C��s��+$\frac{1}{2}$O2��g��=CO��g������H=-110.5kJ•mol-1��
��Cu��s��+$\frac{1}{2}$O2��g��=CuO��s������H=-157kJ•mol-1
�ݸ�˹����������֪�Ȼ�ѧ����ʽ���������Ȼ�ѧ����ʽ���
��2��NO��g��+O3��g���TNO2��g��+O2��g����H=-200.9kJ��mol-1��
NO��g��+$\frac{1}{2}$O2��g���TNO2��g����H=-58.2kJ��mol-1��
�ݸ�˹����������֪�Ȼ�ѧ����ʽ���������Ȼ�ѧ����ʽ���
��� �⣺��1����֪����2Cu��s��+$\frac{1}{2}$O2��g��=Cu2O��s������H=-169kJ•mol-1��
��C��s��+$\frac{1}{2}$O2��g��=CO��g������H=-110.5kJ•mol-1��
��Cu��s��+$\frac{1}{2}$O2��g��=CuO��s������H=-157kJ•mol-1
�ݸ�˹���ɣ���+��-2���۵ã�C��s��+2CuO��s��=Cu2O��s��+CO��g����H=+34.5KJ/mol��
�ʴ�Ϊ��C��s��+2CuO��s��=Cu2O��s��+CO��g����H=+34.5KJ/mol��
��2��NO��g��+O3��g���TNO2��g��+O2��g����H=-200.9kJ��mol-1 ��
NO��g��+$\frac{1}{2}$O2��g���TNO2��g����H=-58.2kJ��mol-1��
������ʽ2��+��3NO��g��+O3��g��=3NO2��g�������ԡ�H=2����-58.2kJ��mol-1��+��-200.9kJ��mol-1��=-317.3kJ/mol��
�ʴ�Ϊ��-317.3��
���� ����Ϊ�����˸�˹���ɽ����ʱ�ļ���֪ʶ�㣬�ۺ��Խ�ǿ�����ؿ���ѧ�����������������ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ϡ���ᷴӦ��Fe+2H+=Fe2++H2 | |
| B�� | �Ȼ�����Һ��ͨ������CO2��Ba2++CO2+H2O=BaCO3��+2H+ | |
| C�� | ̼�������Һ�����ᷴӦ��HCO3-+H+=CO2��+H2O | |
| D�� | ����ʯ��ˮ�е���������NaHCO3��Һ��Ca2++2OH-+2HCO3-=CaCO3��+CO32-+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | �ó����ʯ��ˮ�ɼ���NaHCO3��Na2CO3 | |
| B�� | Na2CO3�����ȶ��Դ���NaHCO3 | |
| C�� | �ڵڢۡ��ܡ��ݲ����У���Ԫ�ؾ������� | |
| D�� | ��ҵ��ͨ����ⱥ��MgCl2��Һ��ȡ����þ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
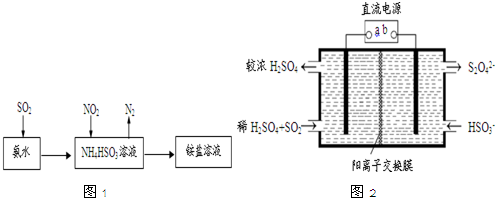
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ij��Һ�м���ϡ���ᣬ����ʹ����ʯ��ˮ����ǵ����壬����Һ��һ������CO32- | |
| B�� | ��ij��Һ�еμ���ˮ���ټ���KSCN��Һ����Һ��죬����Һ��һ������Fe2+ | |
| C�� | ��ij��Һ��ͨ��Cl2����Һ��ƣ������ӵ�����Һ����Һ������˵��ԭ��Һ����I- | |
| D�� | �ò�˿պȡij��Һ������ɫ��Ӧ������ʻ�ɫ������Һһ����������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 75 mL 2 mol•L-1 ��NH4Cl | B�� | 150 mL 1 mol•L-1 ��NaCl | ||
| C�� | 50 mL 1.5 mol•L-1 ��CaCl2 | D�� | 50 mL 3 mol•L-1 ��KClO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
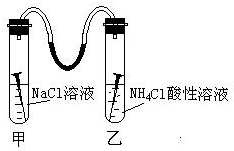 ��ͼ��ʾ���ס������Թ��и���һö��������װ������ˮ�IJ���������ӣ����Թ�����NaCl��Һ�����Թ�����NH4Cl��Һ�������ԣ�������۲쵽�������ǣ��������Һ������ҵͣ���ߡ��ͣ���д�����Թ���������Ӧʽ��O2+2H2O+4e-�T4OH-�����Թܸ�����Ӧʽ
��ͼ��ʾ���ס������Թ��и���һö��������װ������ˮ�IJ���������ӣ����Թ�����NaCl��Һ�����Թ�����NH4Cl��Һ�������ԣ�������۲쵽�������ǣ��������Һ������ҵͣ���ߡ��ͣ���д�����Թ���������Ӧʽ��O2+2H2O+4e-�T4OH-�����Թܸ�����Ӧʽ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com