
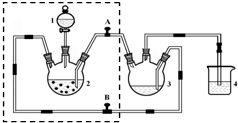
 醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:分析 (1)虚框内为三颈烧瓶和分液漏斗以及导管,可以在分液漏斗里加水的方法检验气密性;
(2)根据本实验的原理可知,先用锌与盐酸反应生成氢气排除装置中的空气,再利用氢气把压入醋酸钠溶液中生成醋酸亚铬水合物,据此判断,装置4是保持装置压强平衡,同时避免空气进入;
(3)配制用的蒸馏水都需事先煮沸,防止氧气氧化Cr2+;
(4)实验开始生成H2气后,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,打开A关闭B,把生成的CrCl2溶液压入装置3中反应;
(5)锌的作用是和盐酸反应生成氢气,增大仪器中的压强班生成的CrCl2溶液压入装置3,与CrCl3充分反应得到CrCl2;
(6)醋酸亚铬水合物不溶于冷水和醚,微溶于醇,易溶于盐酸,据此选择洗涤试剂.
解答 解:(1)虚框内为三颈烧瓶和分液漏斗以及导管,加水检验气密性的方法是将装置连接好,关闭A、B阀门,往装置1中加水,打开活塞后,水开始下滴,一段时间后,如果水不再下滴,表明装置气密性良好.反之,则气密性不好,
故答案为:将装置连接好,关闭A、B阀门,往装置1中加水,打开活塞后,水开始下滴,一段时间后,如果水不再下滴,表明装置气密性良好.反之,则气密性不好;
(2)根据本实验的原理可知,先用锌与盐酸反应生成氢气排除装置中的空气,再利用氢气把压入醋酸钠溶液中生成醋酸亚铬水合物,所以醋酸钠溶液应放在装置3中,盐酸应放在装置1中,装置4是保持装置压强平衡,同时避免空气进入装置3;
故答案为:装置3;装置1;保持装置压强平衡,同时避免空气进入装置3;
(3)本实验中所用的溶液,配制用的蒸馏水都需事先煮沸,原因是,二价铬不稳定,极易被氧气氧化,去除水中的溶解氧,防止Cr2+被氧化;
故答案为:去除水中的溶解氧,防止Cr2+被氧化;
(4)实验开始生成H2气后,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,打开A关闭B,把生成的CrCl2溶液压入装置3中反应;
故答案为:打开;关闭;
(5)锌的作用是和盐酸反应生成氢气,增大仪器中的压强将生成的CrCl2溶液压入装置3,与CrCl3充分反应得到CrCl2,所锌要过量,
故答案为:产生足够的H2;与CrCl3充分反应得到CrCl2;
(6)醋酸亚铬水合物不溶于冷水和醚,微溶于醇,易溶于盐酸,所以可以选用冷水和乙醚洗涤[Cr(CH3COO)2)]2•2H2O产品,故选C.
点评 本题考查了物质制备实验装置分析判断,实验设计方法和物质性质的理解应用,主要是实验原理的分析应用,掌握基础是关键,题目难度中等.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:解答题
 表示某粒子的结构示意图.
表示某粒子的结构示意图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4•5H2O的流程图:
Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4•5H2O的流程图:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
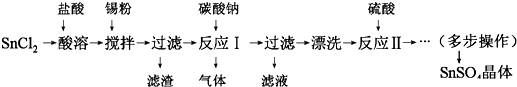
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
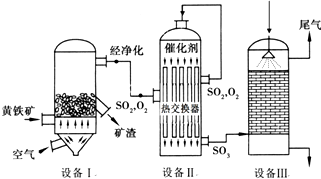
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有④ | B. | 只有⑤ | C. | ①②③ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com