
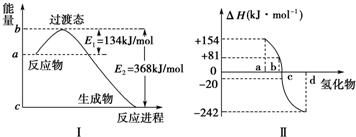
分析 (1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量234kJ;加入催化剂能降低反应所需的活化能,但是不改变反应物的总能量和生成物的总能量;
(2)非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定.a、b、c、d依次为H2Te、H2Se、H2S、H2O,据此解答即可;
(3)向H2SO4溶液中加入100mL 0.4mol•L-1 Ba(OH)2溶液反应涉及的离子方程式有Ba2+(aq)+SO42-(aq)=BaSO4(s),H+(aq)+OH-(aq)=H20(l),向足量Ba(OH)2溶液中加入100mL 0.4mol•L-1 HCl溶液时,反应涉及的离子方程式为H+(aq)+OH-(aq)=H20(l),Na2SO4溶液与BaCl2溶液反应的离子方程式为Ba2+(aq)+SO42-(aq)=BaSO4(s),从能量守恒的角度解答;
(4)利用盖斯定律计算即可.
解答 解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量=368-134=234kJ,加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,故答案为:-234 kJ•mol-1;不变;
(2)非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定.a、b、c、d依次为H2Te、H2Se、H2S、H2O,由于水中存在氢键,故水的沸点最高,故答案为:Se;H2O;H2O>H2Te>H2Se>H2S;
(3)100mL 0.4mol•L-1 Ba(OH)2的物质的量为0.04mol,向H2SO4溶液中加入100mL 0.4mol•L-1 Ba(OH)2溶液反应涉及的离子方程式有Ba2+(aq)+SO42-(aq)=BaSO4(s),H+(aq)+OH-(aq)=H20(l),100mL 0.4mol•L-1 HCl的物质的量为0.04mol,反应涉及的离子方程式为H+(aq)+OH-(aq)=H20(l),根据放出的热量为2.2kJ,
可知H+(aq)+OH-(aq)=H20(l)△H=-$\frac{2.2kJ}{0.04mol}$=-55kJ•mol-1,
设Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-QkJ•mol-1,
则0.04Q+0.08mol×55kJ•mol-1=5.0kJ,解之得Q=15,
所以Na2SO4溶液与BaCl2溶液反应的热化学方程式为Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-15kJ•mol-1,
故答案为:BSO42-(aq)+Ba2+(aq)=BaSO4(s)△H=-15 kJ•mol-1;
(或写成:Na2SO4(aq)+BaCl2(aq)=BaSO4(s)+2NaCl(aq)△H=-15 kJ•mol-1 )
(4)①2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)的△H=-285.8kJ•mol-1,
依据盖斯定律计算①-②×2得到:2H2O(l)═2H2O(g)△H=88KJ/mol;
H2O(l)═H2O(g)△H=44KJ/mol;
蒸发54g液态水物质的量=$\frac{54g}{18g/mol}$=3mol,需吸收的热量3mol×44KJ/mol=132kJ,故答案为:132.
点评 本题主要考查的是吸热反应与放热反应图象分析、盖斯定律的应用、元素周期律的应用等,综合性较强,有一定难度.


科目:高中化学 来源: 题型:选择题

| A. | 氢氧化钾与硫酸的反应 | |
| B. | 高温条件下铝与氧化铁的反应 | |
| C. | 高温条件下碳粉与二氧化碳的反应 | |
| D. | Ba(0H)2•8H20晶体与NH4C1固体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,1L0.5mol•L-1NH4Cl溶液与1L0.25mol•L-1NH4Cl溶液中NH4+物质的量之比为2:1 | |
| B. | 100g硫酸溶液的物质的量浓度为18.4mol/L,用水稀释到物质的量浓度为9.8mol/L,需要水100g. | |
| C. | 标准状况下,22.4LCH3Cl和CHCl3的混合物中所含有的碳原子个数一定为NA | |
| D. | 在2Na2O2+2CO2=2Na2CO3+O2反应中,每生成16g氧气,则转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液,溴水 | B. | 碳酸钠溶液,溴水 | ||
| C. | 高锰酸钾酸性溶液,溴水 | D. | 高锰酸钾酸性溶液,氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②的反应物总能量比①的反应物总能量低 | |
| B. | ①中的I2为固态,②中的I2为气态 | |
| C. | ①的产物比②的产物热稳定性更好 | |
| D. | 1mol固态碘升华时将吸热17kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaClO属于共价化合物 | |
| B. | “84”消毒液在空气中久置会变质 | |
| C. | 1L 0.1mol?L-1NaClO溶液中ClO-的数目为0.1NA | |
| D. | ClO-与Ca2+、Fe2+、Al3+ 能大量共存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com