
(14分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液。
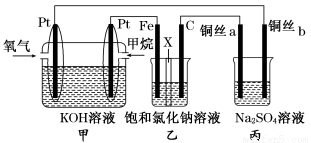
请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是: 。
(2)石墨电极(C)的电极反应式为______________________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为___ L。
(4)铜丝a处在开始一段时间的现象为______________;原因是________________________________________________________________________。
(5)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________。
a.电能全部转化为化学能
b.粗铜接电源正极, 发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(6)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应为____________________________。
(14分)每个空2分
(1)CH4-8e-+10OH-===CO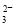 +7H2O
+7H2O
(2)2Cl--2e-===Cl2↑ (3)4.48
(4)溶液变红 由于2H++2e-= H2↑,水的电离平衡正向移动,使溶液显碱性,酚酞遇碱变红(5)bd
(6)4H++O2+4e-===2H2O
【解析】
试题分析:燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极。
(1)燃料电池中,负极上投放燃料所以投放甲烷的电极是负极,负极上失电子发生氧化反应,电极反应式为:CH4+10OH--8e-=CO32-+7H2O。
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨电极是阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑。
(3)串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,则转移电子的物质的量=2.24L÷22.4L/mol×4=0.4mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;丙装置中阴极上析出铜,设析出铜的质量为yg,
2H++2e- =H2↑
2mol 22.4L
0.4mol xL
解得 x=4.48。
(4)铜丝a连接燃料电池的负极,为阴极,发生的电极反应为:2H++2e-= H2↑,所以水的电离平衡正向移动,使溶液显碱性,酚酞遇碱变红。
(5)CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼。a.电能只有部分转化为化学能,还有热能等能量的转化,故a错误;b.电解时,粗铜接电源正极,作阳极,该极上发生氧化反应,故b正确;c.电解池中的阳离子移向阴极,即溶液中Cu2+向阴极移动,故c错误;d.不参与电极反应的Ag、Pt、Au等金属可以形成阳极泥,故从阳极泥中可回收Ag、Pt、Au等金属,故d正确。
(6)原电池正极发生的是化合价降低得电子的反应,根据方程式可知是O2得电子,由于H2SO4存在,所以发生的O2酸性条件下的电极反应:4H++O2+4e-═2H2O。
考点:本题考查电解原理与原电池原理及应用。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届山东省济宁市高三10月阶段测试化学试卷(解析版) 题型:选择题
关于物质的分类正确的是( )
A.SO2、CO2、CO、NO2都是酸性氧化物
B.Na2O、Na2O2、Fe2O3、CuO都是碱性氧化物
C.HCl、HClO、HNO3、HClO4都是强酸
D.NaOH、KOH、Ba(OH)2、Ca(OH)2都是强碱
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次(10月)检测化学试卷(解析版) 题型:选择题
下列有关实验装置进行的相应实验,能达到实验目的的是 ( )
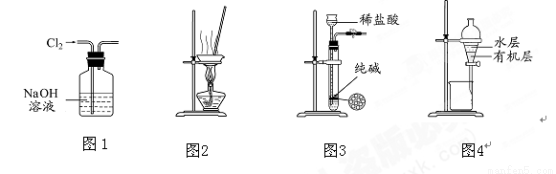
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
在下列溶液中,各组离子一定能够大量共存的是
A.常温下水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、ClO-、F-、K+
B.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br-
C.含有大量Al3+的溶液:Na+、Cl-、S2-、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO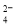 、S2-、SO
、S2-、SO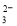
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
下列有关实验的做法错误的是
A.用苯从溴水中提取溴,有机层从分液漏斗的上口倒出
B.实验室可以用浓氨水和生石灰制备NH3
C.实验室中用加热方法分离碘和食盐的混合物
D.加入适量的NaOH可除去NaHCO3溶液中混有的少量Na2CO3
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
将Q和R加入到密闭体系中,在一定条件下发生反应3Q(s)+R(g)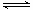 2W(g)。平衡时W的体积分数随温度和压强的变化如下表所示:
2W(g)。平衡时W的体积分数随温度和压强的变化如下表所示:
| 1 MPa | 2 MPa | 3 MPa |
500℃ | 45.3% |
|
|
700℃ | a | 66.7% |
|
900℃ |
|
| 73.6% |
下列说法正确的是
A.该反应的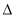 H<0
H<0
B.45.3%<a<66.7%
C.该反应的平衡常数K(900℃)>K(700℃)
D.700℃、2 MPa时R的转化率为50%
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
下列说法正确的是( )
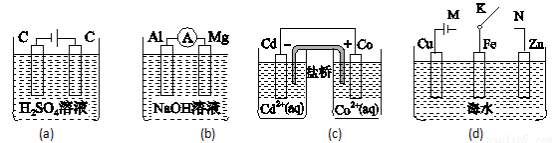 A.图(a)中,随着电解的进行,溶液中H+的浓度越来越小
A.图(a)中,随着电解的进行,溶液中H+的浓度越来越小
B.图(b)中,Mg电极作电池的负极
C.图(c)中,发生的反应为Co+Cd2+= Cd+Co2+
D.图(d)中,K分别与M、N连接时,Fe电极均受到保护
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(A卷)(解析版) 题型:实验题
(18分)按要求回答下列问题
(1)某小组同学探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
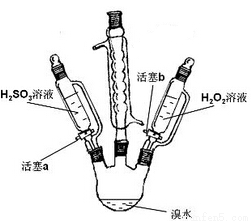
①打开活塞a,逐滴加入H2SO3溶液到过量,烧瓶内溶液变为无色,该反应的离子方程式为________,得出的结论是:H2SO3的氧化性比Br2的氧化性______(填“强”或“弱”)。
②再打开活塞b,向所得溶液中逐滴加入H2O2,刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色,变橙黄色反应的离子方程式为_____________________________,得出的结论是H2O2的氧化性比Br2的氧化性____(填“强”或“弱”)。
(2)某学习小组向盛有氯化钡溶液的试管中通入二氧化硫气体,发现有白色沉淀,为了清楚沉淀的物质,研究小组向试管中加入过量稀盐酸,沉淀不溶解,你认为沉淀物是____________,产生该物质可能的原因是________________________。
(3)为探究SO2使品红溶液褪色的原因,该小组同学将干燥的SO2气体通入品红的四氯化碳溶液中,发现品红不褪色,由此所得出的结论正确的是__________(填编号)。
a.SO2使品红溶液褪色的微粒一定不是SO2分子
b.SO2使品红溶液褪色的微粒一定是H2SO3分子
c.此实验无法确定SO2使品红溶液褪色的微粒
d.将干燥的SO2气体通入品红的酒精溶液中,能使品红褪色由此可猜想使品红溶液褪色的微粒可能是___________________________。
(4)配平并完成下列离子方程式___MnO4-+___H2O2+___ ____=__Mn2++__O2+__H2O每有1mol高锰酸根参加反应,生成_______mol O2。
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三10月月考化学试卷(解析版) 题型:选择题
已知下列实验事实:①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;②将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝;③向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液。下列判断不正确的是
A.化合物KCrO2中Cr元素为+3价
B.实验①证明Cr2O3是两性氧化物
C.实验②证明氧化性:Cr2O72->I2
D.实验③证明H2O2既有氧化性又有还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com