
 ;Cl-
;Cl-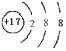 .
. 分析 镁原子核内有12个质子,核外12个电子,分布在三个电子层,从内到外依次容纳2,8,2个电子;
氯离子核内有17个质子,核外有18个电子,分布在三个电子层,从内到外依次容纳2,8,8个电子;
解答 解:
(1)镁原子核内有12个质子,核外12个电子,分布在三个电子层,从内到外依次容纳2,8,2个电子,原子结构示意图: ,
,
故答案为: ;
;
氯离子核内有17个质子,核外有18个电子,分布在三个电子层,从内到外依次容纳2,8,8个电子,离子结构示意图为: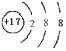 ;
;
故答案为: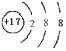 ;
;
点评 本题考查了原子、离子结构示意图的书写,明确微粒核内质子数与核外电子数目,明确核外电子排布规律是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| NO的物质的量(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水洗涤2~3次后再使用 | |
| B. | 用滤纸擦干后才可使用 | |
| C. | 用盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色,才可使用 | |
| D. | 用盐酸洗涤后,经蒸馏水冲洗,方可使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com