
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
【答案】D
【解析】
A.根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;平衡常数只与温度有关,温度不变,平衡常数不变;
B.增大压强,平衡向气体体积减小的方向移动;
C.根据v=![]() 进行计算;
进行计算;
D.计算出此时的Qc与K比较,判断反应进行的方向。
PCl5(g)![]() PCl3(g)+Cl2(g),
PCl3(g)+Cl2(g),
A.I中K=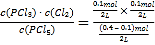 ≈0.03mol/L,平衡常数只与温度有关,温度不变,平衡常数不变,则容器Ⅱ中得到平衡常数与容器I中相同,容器III中K=
≈0.03mol/L,平衡常数只与温度有关,温度不变,平衡常数不变,则容器Ⅱ中得到平衡常数与容器I中相同,容器III中K=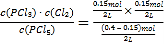 =0.045mol/L,即平衡常数K:容器Ⅱ<容器Ⅲ,A错误;
=0.045mol/L,即平衡常数K:容器Ⅱ<容器Ⅲ,A错误;
B.容器Ⅱ与容器Ⅰ相比,相当于增大压强,增大压强,化学平衡气体体积减小的逆反应方向移动,PCl5的转化率减小,即PCl5的转化率:容器Ⅱ<容器Ⅰ,B错误;
C.对于容器I,反应到达平衡时,反应的PCl5的物质的量为0.1mol,故v(PCl5)=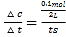 =
=![]() mol/(Ls),C错误;
mol/(Ls),C错误;
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则此时Qc=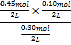 =0.075mol/L>0.045mol/L,所以化学平衡向逆反应方向移动,D正确;
=0.075mol/L>0.045mol/L,所以化学平衡向逆反应方向移动,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,1 L 己烷完全燃烧后,所生成的气态产物的分子数为![]() NA
NA
B.10 g 46%的乙醇溶液中氢原子的个数为 0.6 NA
C.28 g 乙烯与丙烯的混合气体,共用的电子对数为 6 NA
D.100 mL 0.1 mol/L CH3COOH 溶液跟足量乙醇、浓硫酸共热,发生酯化反应,生成乙酸乙酯分子 数为 0.01 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是![]()
A.金刚石、SiC、NaF、NaCl、![]() 、
、![]() 晶体的熔点依次降低
晶体的熔点依次降低
B.CaO晶体结构与NaCl晶体结构相似,CaO晶体中![]() 的配位数为6,且这些最邻近的
的配位数为6,且这些最邻近的![]() 围成正八面体
围成正八面体
C.设NaCl的摩尔质量为![]() ,NaCl的密度为
,NaCl的密度为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]()
![]() ,在NaCl晶体中,两个距离最近的
,在NaCl晶体中,两个距离最近的![]() 中心间的距离为
中心间的距离为
D.X、Y可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角位置,则该晶体的化学式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,向某恒容密闭容器中加入1.6 mol ·L-1的Q后会发生如下反应:2Q(g) ![]() M(g) 。其中M的物质的量浓度随时间的变化如图所示。
M(g) 。其中M的物质的量浓度随时间的变化如图所示。
下列说法错误的是
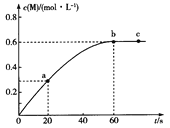
A.从反应开始到刚达到平衡时间段内,v(Q)=0.02 mol·L-1·s-1
B.a、b两时刻生成Q的速率:v(a)<v(b)
C.用Q浓度变化值表示的ab、bc两个时段内的反应速率:v(ab)>v(bc)=0
D.其他条件相同,起始时将0. 2 mol·L-1氦气与Q混合,则反应达到平衡所需时间少于60 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如右图所示。下列说法正确的是( )
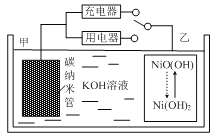
A.放电时,甲电极为正极,OH-移向乙电极
B.放电时,乙电极反应为Ni(OH)2+OH--e-=NiO(OH)+H2O
C.充电时,电池的甲电极与直流电源的正极相连
D.电池总反应为H2+2NiOOH![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
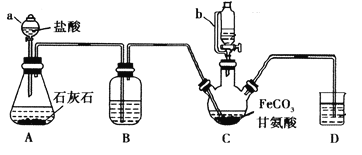
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池在商业、宇航潜艇、核武器等领域有广泛应用。一种从正极片(含Ag、Ag2O、石墨及Cu等)中回收银的流程如下,下列叙述错误的是
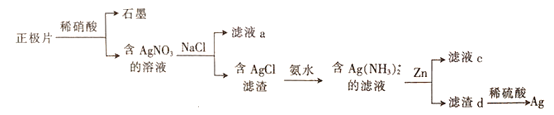
A. 滤液a中含有Na+、Cu2+、H+等阳离子
B. A用氨水溶解时发生的反应为AgCl+2NH3H2O=[Ag(NH3)2]++C1-+2H2O
C. 滤液c可浓缩结晶得到Zn(NO3)2
D. 向滤渣d中加稀硫酸可溶解其中过量的Zn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
①盐卤(含MgCl2)![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() 无水MgCl2
无水MgCl2
②铝土矿![]() AlO2-
AlO2-![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3
③NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
④NaCl溶液![]() Cl2
Cl2![]() 无水FeCl2
无水FeCl2
⑤S![]() SO3
SO3![]() H2SO4
H2SO4
⑥SiO2![]() Na2SiO3溶液
Na2SiO3溶液![]() H2SiO3
H2SiO3
A. ③⑥B. ③⑤⑥C. ①④⑤D. ①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、W的原子序数依次增加。m、P、r是由这些元素组成的二元化合物,n是W的单质,q是Y的单质,s是Z的单质且常温下为淡黄色固体,m 与r相遇会产生白烟。上述物质的转化关系如图所示。下列说法错误的是

A. 原子半径:z>W>X
B. Y的一种氢化物可作为制冷剂
C. Z的氧化物对应的水化物酸性一定比W的弱
D. X、Y、W三种元素组成的化合物可为离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com