
����Ŀ��ij�������ؾ�ʯ(��Ҫ��BaSO4)Ϊԭ�ϣ������������մɹ�ҵ֧���������ᱵ(BaTiO3)![]() �Ĺ����������£�
�Ĺ����������£�
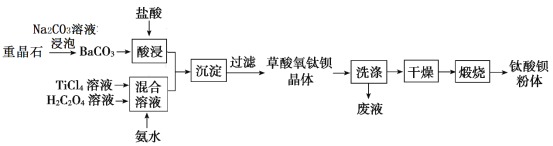
��֪��
(1)Ksp(BaSO4)=1.0��10��10 ��Ksp(BaCO3)=5.0��10-9
(2)�������ѱ�����Ļ�ѧʽΪ BaTiO(C2O4)2��4H2O
�ش��������⣺
(1)Ϊ���BaCO3��������ʣ��ɲ�ȡ�Ĵ�ʩΪ_________(д��һ��)��
(2)����һ��Ũ�ȵ�TiCl4��Һʱ��ͨ���ǽ�TiCl4(������ΪҺ��)________________��
(3)��Na2CO3��Һ���ؾ�ʯ(�������ʲ���Na2CO3��Һ����)�����ﵽƽ��������ϲ���Һ���ظ���β�������BaSO4ת��ΪBaCO3���˷�Ӧ��ƽ�ⳣ��K=______(��д������)����������CO32-��ˮ�⣬��������Ҫʹ��Ũ��Ϊ_____mol/LNa2CO3��Һ�����ؾ�ʯ���ܿ�ʼ��ת�����̡�
(4)���ʵ�鷽����֤�������ѱ������Ѿ�ϴ�Ӹɾ���______________________________��
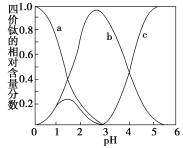
(5)�������ҺҺ�����ڣ���Ԫ���ڲ�ͬpH����Ҫ��TiOC2O4��TiO(C2O4)22-��TiO(OH)+������ʽ���ڣ���ͼ��ʾ��ʵ���Ʊ������У����ð�ˮ���ڻ����Һ��pH��2.5��3֮�䣬�ٽ���������������ͼ������a��Ӧ�ѵ���ʽΪ_____(�ѧʽ)��д����������ʱ�����ӷ���ʽ��___________��
(6)���ղ������ѱ�����õ�BaTiO3����ʽΪ��__________��
���𰸡���BaCO3�гɷ�ĩ���ʵ���������Ũ�Ȼ��ʵ����Ȼ����� ����Ũ���ᣬ�ټ�����ˮϡ��������Ũ�ȡ� 0.02 5.0��10-4 ȡ�������һ��ϴ��Һ������ϡ�����ữ�����������������ɣ�˵�������Ѿ�ϴ�Ӹɾ� TiOC2O4 TiO(C2O4)22-��Ba2��+4H2O=BaTiO(C2O4)2��4H2O�� BaTiO(C2O4)2��4H2O![]() BaTiO3+2CO��+2CO2��+4H2O
BaTiO3+2CO��+2CO2��+4H2O
��������
(1)�������ʵĴ���״̬��Ӱ�컯ѧ��Ӧ���ʵ����ط�����
(2)������ǿ�������Σ�����Һ������������ˮ�⣬��������ˮ�⿼�ǣ�
(3)���ݳ�����ת��ƽ�ⷽ��ʽ��д�����㣻
(4)�������ѱ�����Ӻ���HCl��TiCl4��Һ�в�����ֻҪ֤��ϴ��Һ����Cl-����֤��ϴ�Ӹɾ���
(5) �������Һ�����ڣ���Ԫ���ڲ�ͬpH����Ҫ��TiOC2O4��TiO(C2O4)22-��TiO(OH)+������ʽ���ڣ�����������ʱ���ɲ������ѱ������к���TiO(C2O4)22-(��b��)�����Ű�ˮ�IJ��ϼ���C2O42-Ũ������������ƣ������ж�a��Ӧ�ѵ���ʽΪTiOC2O4���ٸ��ݷ�Ӧǰ�����Ԫ�ص�ԭ�Ӹ����غ㼰����Ļ�ѧʽ��д����Ӧ�Ļ�ѧ����ʽ��
(6)�������ѱ��������յõ�BaTiO3��ͬʱ�õ�CO��CO2��ˮ������
(1)������BaCO3������Ӧ��2HCl+BaCO3=BaCl2+H2O+CO2����Ϊ�˼ӿ췴Ӧ���ʡ������Խ�����BaCO3�гɷ�ĩ��������Ӵ������Ҳ�����ʵ���������Ũ�Ȼ��ʵ��������߷�Ӧ�¶Ȼ����ȵȣ�
(2) TiCl4��ǿ�������Σ�����Һ��Ti4+�ᷢ��ˮ�ⷴӦ��Ti4++4H2O![]() Ti(OH)4+4H+��ʹ��Һ�����Ϊ�����Ƶõ������TiCl4��Һ��ͬʱ����������������ͨ���ǽ�TiCl4����Ũ�����У�Ȼ���ټ�����ˮϡ��������Ũ�ȣ�
Ti(OH)4+4H+��ʹ��Һ�����Ϊ�����Ƶõ������TiCl4��Һ��ͬʱ����������������ͨ���ǽ�TiCl4����Ũ�����У�Ȼ���ټ�����ˮϡ��������Ũ�ȣ�
(3) ����Һ��BaSO4���ڳ����ܽ�ƽ�⣬������Һ�м��뱥��Na2CO3��Һʱ����������ת������BaCO3��BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq)�����ﵽƽ��������ϲ���Һ���ظ���β���������BaSO4����BaCO3����Ӧ��ƽ�ⳣ��K=
BaCO3(s)+SO42-(aq)�����ﵽƽ��������ϲ���Һ���ظ���β���������BaSO4����BaCO3����Ӧ��ƽ�ⳣ��K=![]() 0.02����BaSO4������Һ�У�����Ksp(BaSO4)=1.0��10��10��֪c(Ba2+)=1.0��10��5mol/L��������CO32-��ˮ�⣬Ҫʵ�ֳ�����ת������c(Ba2+)c(CO32-)> Ksp(BaCO3)��c(CO32-)>5.0��10��9��1.0��10��5=5.0��10-4mol/L����������Ҫʹ��Ũ��Ϊ5.0��10-4mol/LNa2CO3��Һ���ݣ�
0.02����BaSO4������Һ�У�����Ksp(BaSO4)=1.0��10��10��֪c(Ba2+)=1.0��10��5mol/L��������CO32-��ˮ�⣬Ҫʵ�ֳ�����ת������c(Ba2+)c(CO32-)> Ksp(BaCO3)��c(CO32-)>5.0��10��9��1.0��10��5=5.0��10-4mol/L����������Ҫʹ��Ũ��Ϊ5.0��10-4mol/LNa2CO3��Һ���ݣ�
(4) HCl��TiCl4��H2C2O4��Ϸ�Ӧ�����������ѱ����壬��������˺�ϴ�Ӹɾ�����ϴ��Һ�в�����Cl-������֤�������ѱ������Ѿ�ϴ�Ӹɾ��ķ�����ȡ�������һ��ϴ��Һ������ϡ�����ữ�����������������ɣ�˵�������Ѿ�ϴ�Ӹɾ���
(5) �������Һ�����ڣ���Ԫ���ڲ�ͬpH����Ҫ��TiOC2O4��TiO(C2O4)22-��TiO(OH)+������ʽ���ڣ�����������ʱ���ɲ������ѱ������к���TiO(C2O4)22-(��b��)�����Ű�ˮ�IJ��ϼ��룬C2O42-Ũ������������ƿ����ж�a��Ӧ�ѵ���ʽΪTiOC2O4��b��Ӧ�ѵ���ʽΪTiO(C2O4)22-��c��Ӧ�ѵ���ʽΪTiO(OH)+������������ʱ�����ӷ���ʽΪ��TiO(C2O4)22-��Ba2��+4H2O=BaTiO(C2O4)2��4H2O��
(6)�������ѱ��������յõ�BaTiO3��ͬʱ�õ�CO��CO2��ˮ���������ղ������ѱ�����õ�BaTiO3����ʽΪBaTiO(C2O4)2��4H2O![]() BaTiO3+2CO��+2CO2��+4H2O��
BaTiO3+2CO��+2CO2��+4H2O��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ý���ʵ�飬��ʵ��ʵ��Ŀ�ĵ��ǣ���Ҫʱ�ɼ��ȣ�
ѡ�� | ʵ��Ŀ�� | �� | �� | �� |
|
A | ֤��Ũ�������ǿ������ | Ũ���� | ̼�� | ��ˮ | |
B | ��֤Cl2��Ư���� | Ũ���� | MnO2 | ����ĺ�ɫ���� | |
C | ��֤NH3����ˮ�Լ��� | Ũ��ˮ | ��ʯ�� | ʪ�����ɫʯ����ֽ | |
D | �Ƚ�H2CO3��H2SiO3������ | ������Һ | ̼���� | ��������Һ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ�ѧ���ʣ����������������ж�����;��
��1���Ӻ�ˮ�л��ʳ�εķ�����Ϊ___________��NaCl�ĵ���ʽ��________��
��2��ʵ���ҵ�ⱥ��ʳ��ˮ��װ������ͼ��ʾ�������ж���ȷ����_________��ѡ���ţ���

A���缫aΪ����
B���缫b�Ϸ����˻�ԭ��Ӧ
C������������Һ���
D��������������ɫ����
��3����ҵ���õ�ⱥ��ʳ��ˮ�ķ�����ȡ������д���÷�Ӧ�Ļ�ѧ����ʽ��________________________________________________________�����õ�����1.12L����״���£�ʱ��ת�Ƶĵ�����Ϊ______mol��
��4�����ʱӦ��������������Ӵ���������ܷ�������Ӧ��д��������һ�ֵ�����һ�ֻ����ﷴӦ�Ļ�ѧ����ʽ��_______________________________ ��
��5�������ж�������Ҳ��������������ԭ����_________________________��
��6��ijͬѧ��������������ʵ�飺
����ʢ��KI��Һ���Թ��еμ�������ˮ���ټ�������CCl4�������ú�ɹ۲쵽______________________________��
������������Թ��еμ���ˮ����CCl4������ɫ����dz���������ɫ��������˵����ȷ����___________
a��CCl4�������ʱ����� b��CCl4������
c��CCl4�������ʱ���ԭ d��CCl4����ԭ
��7��������һ�������Դ����������ͨ����ⱥ��ʳ��ˮ���ģ�������������Ƿ�ͬ��ù۵㣿������������Ҫ���͡�______________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������NO2����һ����Ҫ�Ĵ�����Ⱦ�������д�����
��1����������������ʱ������N2��O2��Ӧ����NO���䷴Ӧ�����е������仯���£�
��Ӧ | N2(g)��2N(g) | O2(g)��2O(g) | N(g)��O(g)��NO(g) |
��Ӧ�� | ��H1 | ��H2 | ��H3 |
����ֵkJ/mol | 945 | 498 | 630 |
�١�H1___0����H3____0��������>������<����
��N2��g��+O2��g��=2NO��g����H=____kJ��mol-1��
��2�����ü������ԭ���������֪��
CH4��g��+4NO2��g��==4NO��g��+CO2��g��+2H2O��g����H=-574kJ��mol-l
CH4��g��+4NO��g��==2N2��g��+CO2��g��+2H2O��g��AH=-1160 kJ��mol-l
H2O��l��=H2O��g����H=+44kJ��mol-l
CH4��NO2��Ӧ����N2��H2O(l)���Ȼ�ѧ����ʽΪ_______��
��3��DZͧ��ʹ�õ�Һ��-Һ��ȼ�ϵ�ع���ԭ����ͼ��ʾ��

���缫a������______��
���������Һ��OH-������_____�ƶ��������缫a�������缫b������
���缫b�ĵ缫��ӦʽΪ_____��
��4����ͨ��NH3��NaClO��Ӧ���Ƶû��ȼ���£�N2H4�����÷�Ӧ�Ļ�ѧ��Ӧ����ʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��˵����ȷ����( )
A. ��0.1mol/L CH3COOH��Һ�м�������ˮ����Һ��c(H+)/c(CH3COOH)��С
B. ��CH3COONa��Һ��20��������30�棬��Һ��c(CH3COO-)/[c(CH3COOH). c(OH-)]����
C. �������м��백ˮ�����ԣ���Һ��c(NH4+)/c(Cl-)��1
D. ��pH=3��pH=2�Ĵ�����Һ�кͺ�����NaOH����Һ�������ĵĴ�����Һ������ֱ�ΪVa��Vb����Va >10Vb
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����ڱ��У�Ԫ��������ԭ�������ĵ������������Ա仯�ı���ԭ���ǣ� ��
A.������������
B.���ԭ������������
C.��������Ų����������Ա仯
D.Ԫ�ػ��ϼ۳��������Ա仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ú�ĸ����������ȷ���ǣ� ��
��ú��ǿ�ȶ��ֽ�Ĺ��̾ͽ�ú�ĸ���
��ú������Եõ�ұ���õ����ʽ�̿
��ú�ĸ����ʯ�͵ķ���ı������𣺸����ǻ�ѧ�仯���������������仯
�ܷ��ࡢ������ú�ĸ���õ����������ú�������õĽ�¯����
A.�٢�B.�٢�C.�ڢ�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���![]() (I)��
(I)��![]() (II)��
(II)��![]() (III)��
(III)��![]() (IV)�������˵����ȷ����
(IV)�������˵����ȷ����
A. ���������������ķе��������� B. �������һ�ȴ����ֻ������
C. ��������̼ԭ�ӿ��ܶ�����ͬһƽ�� D. �����������ڷ����廯�����Ϊͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������װ�û�����ܴﵽĿ�ĵ���


A. װ�������ڲⶨ��������������
B. װ����������ɫ�����Ƚ�Ũ�ȶԷ�Ӧ���ʵ�Ӱ��
C. װ��������U������Һ��ĸߵ��ж�Na��ˮ��Ӧ����ЧӦ
D. װ�������ݳ��ֻ��ǵĿ����Ƚ��¶ȶԷ�Ӧ���ʵ�Ӱ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com