
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
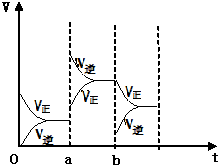 (1)有甲、乙两容器,甲的容积固定,乙的容积可变.在一定温度下,向甲中通入3molN2和4molH2,反应达到平衡时,生成NH3物质的量为amol.
(1)有甲、乙两容器,甲的容积固定,乙的容积可变.在一定温度下,向甲中通入3molN2和4molH2,反应达到平衡时,生成NH3物质的量为amol.查看答案和解析>>
科目:高中化学 来源: 题型:
 和一个-Cl,它的可能结构分别是
和一个-Cl,它的可能结构分别是查看答案和解析>>
科目:高中化学 来源: 题型:
 用50mL0.25mol/L H2SO4与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.
用50mL0.25mol/L H2SO4与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液态HCl不导电,所以HCl不是电解质 |
| B、NH3溶于水形成的溶液能导电,所以NH3是电解质 |
| C、SO2溶于水能导电,所以SO2是电解质 |
| D、BaSO4在水溶液中难导电,但熔融状态下能导电,所以BaSO4是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 molFe3O4与足量的硝酸反应,转移的电子数为2NA |
| B、均是1mol的 Na、Al、Fe分别与足量的盐酸反应,生成氢气的分子数分别是0.5NA、1.5NA、1NA |
| C、5.6g的铁完全参与反应,变为离子时失去的电子数目约为0.2NA |
| D、0.1NA铝与足量的盐酸反应比与足量的氢氧化钠溶液反应生成的H2分子数多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com