已知100mL 0.1mol?L-1 的NaHSO4溶液中H+的物质的量浓度为0.1mol?L-1,请回答下列问题:
(1)写出NaHSO4在水溶液中电离的方程式______.
(2)若向上述NaHSO4溶液中加入0.2mol?L-1Ba(OH)2溶液,使溶液恰好呈中性,写出该反应的离子方程式并计算所需Ba(OH)2溶液的体积以及生成BaSO4沉淀的质量.
解:(1)NaHSO
4在水溶液中电离出钠离子、氢离子、硫酸根,电离方程式为NaHSO
4=Na
++H
++SO
42-,
故答案为:NaHSO
4=Na
++H
++SO
42-;
(2)NaHSO
4溶液与Ba(OH)
2溶液反应恰好呈中性,发生反应2NaHSO
4+Ba(OH)
2=BaSO
4↓+Na
2SO
4+2H
2O,离子方程式为:2H
++SO
42-+Ba
2++2OH
-=BaSO
4↓+2H
2O,
100mL0.1mol?L
-1的NaHSO
4溶液中则n(NaHSO
4)=0.1L×0.1mol?L
-1=0.01mol,根据2NaHSO
4+Ba(OH)
2=BaSO
4↓+Na
2SO
4+2H
2O可知,参加反应的n[Ba(OH)
2]=0.01mol×

=0.005mol,生成的n(BaSO
4)=0.01mol×

=0.005mol,故需要Ba(OH)
2溶液的体积为

=0.025L=25mL,生成BaSO
4沉淀的质量为0.005mol×233g/mol=1.165g,
答:反应离子方程式为2H
++SO
42-+Ba
2++2OH
-=BaSO
4↓+2H
2O,故需要Ba(OH)
2溶液的体积为25mL,生成BaSO
4沉淀的质量为1.165g.
分析:(1)NaHSO
4在水溶液中电离出钠离子、氢离子、硫酸根;
(2)NaHSO
4溶液与Ba(OH)
2溶液反应恰好呈中性,发生反应2NaHSO
4+Ba(OH)
2=BaSO
4↓+Na
2SO
4+2H
2O,据此计算Ba(OH)
2、BaSO
4的物质的量,再根据V=
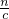
计算Ba(OH)
2溶液的体积,根据m=nM计算BaSO
4沉淀的质量
点评:本题考查离子方程式的书写、化学反应有关计算,难度中等,注意恰好反应呈中性,沉淀量不是最大.

 =0.005mol,生成的n(BaSO4)=0.01mol×
=0.005mol,生成的n(BaSO4)=0.01mol× =0.005mol,故需要Ba(OH)2溶液的体积为
=0.005mol,故需要Ba(OH)2溶液的体积为 =0.025L=25mL,生成BaSO4沉淀的质量为0.005mol×233g/mol=1.165g,
=0.025L=25mL,生成BaSO4沉淀的质量为0.005mol×233g/mol=1.165g,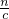 计算Ba(OH)2溶液的体积,根据m=nM计算BaSO4沉淀的质量
计算Ba(OH)2溶液的体积,根据m=nM计算BaSO4沉淀的质量
