
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物用C6H10O5表示。下列有关说法正确的是
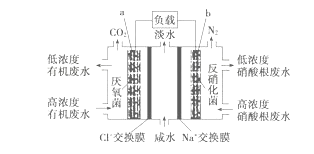
A. b电极为该电池的负极
B. b电极附近溶液的pH减小
C. a电极反应式:C6H10O5-24e-+7H2O===6CO2↑+24H+
D. 中间室:Na+移向左室,Cl-移向右室
【答案】C
【解析】试题分析:该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+。A.该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,故A错误;B.右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,氢离子参加反应导致溶液酸性减小,溶液的pH增大,故B错误;C.左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+,故C正确;D.放电时,电解质溶液中阳离子Na+移向正极右室,阴离子Cl-移向负极室左室,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】工业上制取冰晶石(![]() )的化学方程式为
)的化学方程式为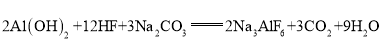 ,反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是( )
,反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是( )
A.简单氢化物的稳定性强弱
B.最高价氧化物对应水化物的碱性或酸性强弱
C.原子达到稳定结构失去或得到电子的多少
D.元素的最高化合价的高低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g),反应过程中的能量变化情况如图所示。
CH3OH(g),反应过程中的能量变化情况如图所示。

(1)曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。该反应是________(填“吸热”或“放热”)反应。计算当反应生成1.5 mol CH3OH(g)时,能量变化是________kJ。
(2)选择适宜的催化剂________(填“能”或“不能”)改变该反应的反应热。
(3)推测反应CH3OH(g)![]() CO(g)+2H2(g)是________(填“吸热”或“放热”)反应。
CO(g)+2H2(g)是________(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CO2中,Mg燃烧生成MgO和C。下列说法正确的是( )
A. 元素C的单质只存在金刚石和石墨两种同素异形体
B. Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C. 在该反应条件下,Mg的还原性强于C的还原性
D. 该反应中化学能全部转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个实验室制取氯气并以氯气为原料进行特定反应的装置:
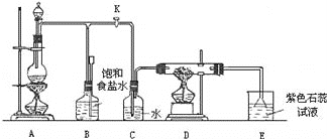
(1)A是氯气发生装置,其中反应的化学方程式为_____。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,连接上E装置。Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:_____。装置C的作用是_____。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是_____。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程现象为_____(选填标号)。
A.有白色沉淀生成 B.无现象 C.先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是_____,B的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍能形成多种不同的化合物。图1是镍的一种配合物的结构,图2是一种镍的氧化物的晶胞。判断下列说法不正确的是( )
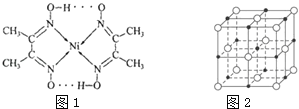
A.图2可能表示的是氧化镍(NiO)的晶胞
B.氧化镍中Ni2+、O2-的配位数都是6
C.镍原子位于元素周期表中第4周期ⅧB族,属于ds区元素
D.图1分子中存在的化学键有共价键、配位键、氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项正确的是
A. 钠与水反应的离子方程式:Na+H2O = Na++OH-+H2↑
B. 氯气与水反应的离子方程式:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C. AlCl3溶液中滴入过量的氨水:Al3++3NH3·H2O = Al(OH)3↓+3NH4+
D. 钠和硫酸铜溶液反应的离子方程式:2Na+Cu2+ = 2Na++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏伽德罗常数的值,下列相关说法正确的是( )
A.2.24LN2和O2的混合气体中分子数为0.1NA
B.2.4g镁在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA
C.标准状况下,22.4LCCl4中含有分子的数目为NA
D.0.1molFeCl3完全水解生成的Fe(OH)3胶体粒子数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com