工业上常利用ClO
2和H
2O
2在碱性条件下反应生产漂白剂亚氯酸钠(NaClO
2),实验室可用如图1装置(略去部分夹持仪器)模拟生产过程.

已知:
Ⅰ.二氧化氯(ClO
2)是一种极易爆炸的强氧化性气体,极易溶于水,在生产和使用时必须尽量进稀释.
Ⅱ.NaClO
2饱和溶液在温度低于38℃时析出晶体NaClO
2?3H
2O,高于38℃时析出晶体NaClO
2,高于60℃时,NaClO
2分解成NaClO
3和NaCl.
(1)装置A中盛放NaClO
2和Na
2C
2O
4的混合固体的仪器为
(填名称).整套实验装置在加入药品之前须进行的实验操作为
.
(2)A中产生ClO
2和CO
2的物质的量之比为
,从实验安全角度分析CO
2气体的作用为
.
(3)装置C中发生的反应的离子方程式为
.
①反应时须保证溶液的碱性在一定pH范围内,下列可精确检测反应过程中溶液酸碱性并对亚氯酸钠的纯度和产率不会造成影响的是( )
a.石蕊 b.酚酞 c.pH试纸 d.pH计
②反应结束后,从溶液中获得晶体NaClO
2的操作步骤为:55℃减压蒸发结晶,趁热过虑、
(填实验操作,要求注明温度)、低于60℃干燥得到成品.
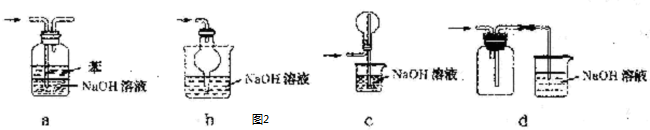
(4)图2中的装置D用于吸收尾气,下列装置可用于装置且合理的是
.
(5)某学习小组碘量法测定粗产品中亚硫酸钠的含量,实验如下:
a.准确称量所得亚氯酸钠样品mg,于小烧杯中,加入适量蒸馏水和过量碘化钾,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液.(已知:ClO
2-+4I
-+4H
+═2H
2O+2I
2+Cl
-)
b.移取25.00mL待测溶液于锥形瓶中,加几滴指示剂,用cmol?L
-1Na
2S
2O
3标准液滴定,到达滴定终点时,消耗Na
2S
2O
3标准液VmL.(已知:I
2+2S
2O
32-═2I
-+S
4O
62-)
①该实验中使用的指示剂为
(写名称);
②该样品中NaClO
2质量分数为
(用含m、c、V的代数式表示,不用化简)





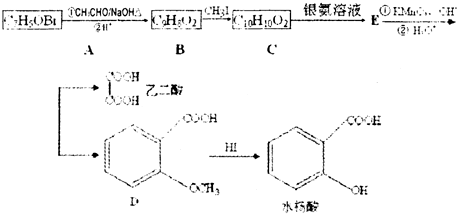
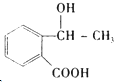 合成
合成 的过程,共有几个步骤.用化学方程式表示其中的第2步和最后一步的反应(注明反应条件)
的过程,共有几个步骤.用化学方程式表示其中的第2步和最后一步的反应(注明反应条件)
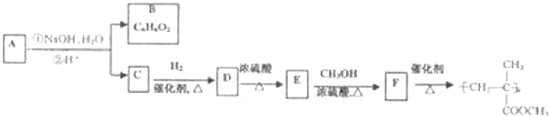
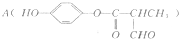 可用于制备有机玻璃(聚甲基丙烯酸甲酯),转化关系如图.
可用于制备有机玻璃(聚甲基丙烯酸甲酯),转化关系如图.