
【题目】根据图1给出的装置图回答下列问题: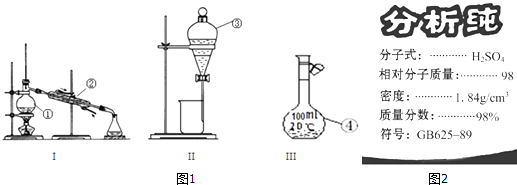
(1)写出下列玻璃仪器的名称:①;② .
(2)①~④中,使用前必须检查是否漏水的是(填仪器序号).分离溴水中的溴应先选择装置(填Ⅰ、Ⅱ或Ⅲ序号)
(3)图2为学校实验室买回的硫酸试剂瓶标签上的部分内容,现欲用此硫酸准确配制浓度为0.18molL﹣1的稀硫酸210mL.
①除量筒、烧杯、玻璃棒、胶头滴管等外,此实验还需要的主要仪器上图有无提供?(填“有”或“无”),如有,在下面横线上填写仪器序号(填①、②、③或④序号),如无,则填写需要怎样的主要仪器: .
②所量取的浓硫酸体积为mL.
③下列操作引起所配溶液浓度偏高的是 .
A.用相同装置配制过0.10mol/L的硫酸溶液后,未清洗即进行此实验的配制
B.移液时未对烧杯和玻璃棒进行洗涤
C.定容时仰视刻度线
D.颠倒摇匀后发现液面低于刻度线,但未加水至刻度线.
【答案】
(1)蒸馏烧瓶,冷凝管
(2)③④,II
(3)无,250ml容量瓶,2.4,A
【解析】解;(1)图中①为蒸馏烧瓶;②为冷凝管;
(2)分液漏斗、容量瓶都能用来盛放液体,且有活塞,使用时必须检查是否漏水;分离溴水中的溴应先加入萃取剂,使溶液分层,然后用分液漏斗进行分液操作分离;
(3)①用浓硫酸配制一定浓度的稀硫酸,步骤为:计算、量取、稀释、移液、洗涤、定容,用到的仪器:量筒、烧杯、玻璃棒、容量瓶、胶头滴管,除量筒、烧杯、玻璃棒、胶头滴管等外,此实验还需要的主要仪器250mL容量瓶,上图中没有;
②浓硫酸物质的量浓度c= ![]() =18.4mol/L,配制浓度为0.18molL﹣1的稀硫酸210mL,应选择250mL容量瓶,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=0.18mol/L×250mL,解得V=2.4mL;
=18.4mol/L,配制浓度为0.18molL﹣1的稀硫酸210mL,应选择250mL容量瓶,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=0.18mol/L×250mL,解得V=2.4mL;
③A.用相同装置配制过0.10mol/L的硫酸溶液后,未清洗即,进行此实验的配制,量取的硫酸的物质的量偏大,溶液浓度偏高,故A选;
B.移液时未对烧杯和玻璃棒进行洗涤,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故B不选;
C.定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故C不选;
D.颠倒摇匀后发现液面低于刻度线,但未加水至刻度线,属于正常操作,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度准确,故D不选;
故答案为:(1)①蒸馏烧瓶;②冷凝管;(2)3、4,II;(3)①无;250ml容量瓶;②2.4;③A.
(1)根据化学常用仪器的名称确定答案即可。
(2)分液漏斗、容量瓶在使用前均需检漏;从溴水中分离溴应先萃取,再分液;
(3)①配制210mL溶液需要用到250mL容量瓶;
②根据公式![]() 、
、![]() 计算所需浓硫酸体积;
计算所需浓硫酸体积;
③所配溶液浓度偏高,则溶质的物质的量偏大,或最终溶液的体积偏小;据此分析选项。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】将3molO2加入到VL的反应器中,在高温下放电,经t1s建立了平衡体系:3O22O3 , 此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是( )
A.
B.
C.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验操作或事故处理方法错误的是
A. 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛
B. 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸
C. 酒精灯着火时可用湿抹布盖灭
D. 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于溶液的稀释下列说法正确的是( )
A.pH=3的醋酸溶液稀释100倍,pH=5
B.pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10﹣6 molL﹣1
C.将1L 0.1molL﹣1的Ba(OH)2溶液稀释为2L,pH=13
D.pH=8的NaOH溶液稀释100倍,其pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时Agl饱和溶液中c(Ag+)为1.22×10﹣6mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10﹣6mol/L.若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
A.c(K+)>c(NO![]() )>c(Cl﹣)>c(Ag+)>c(I﹣)
)>c(Cl﹣)>c(Ag+)>c(I﹣)
B.c(K+)>c(NO![]() )>c(Ag+)>c(Cl﹣)>c(I﹣)
)>c(Ag+)>c(Cl﹣)>c(I﹣)
C.c(NO3﹣)>c(K+)>c(Ag+)>c(Cl﹣)>c(I﹣)
D.c(K+)>c(NO ![]() )>c(Ag+)=(Cl﹣)+c(I﹣)
)>c(Ag+)=(Cl﹣)+c(I﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,将0.4mol/L CH3COOH 溶液和 0.2mol/L NaOH 溶液各 100mL 混合后,pH=5,(设混合后溶液总体积为两溶液体积之和)
(1)混合溶液中离子浓度由大到小的顺序是
(2)①c(CH3COO﹣)+c(CH3COOH)= mol/L②c(CH3COO﹣)﹣c(CH3COOH)= mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1molL﹣1的HA溶液中c(H+)/c(OH﹣)=1010 . 请回答下列问题:
①HA是 (填“强电解质”或“弱电解质”);
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是 (填字母).
A.c(H+)/c(HA) B.c(HA)/(A﹣) C.c(H+)与c(OH﹣)的乘积 D.c(OH﹣)
③若M溶液是由上述HA溶液V1mL与pH=12的NaOH溶液V2mL混合充分反应而得,则下列说法中正确的是
A.若溶液M呈中性,则溶液M中c(H+)+c(OH﹣)=2.0×10﹣7 molL﹣1
B.若V1=V2 , 则溶液M的pH一定等于7
C.若溶液M呈酸性,V1一定大于V2
D.若溶液M呈碱性,V1一定小于V2 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com