
分析 0.1mol•L-1 HA溶液与0.1mol•L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,则说明HA是弱酸,含有弱根离子的盐促进水电离,
①根据盐溶液的pH计算水电离出的c(OH-).根据c(NaOH)及水的离子积常数计算水中氢离子浓度,溶液中氢离子浓度等于水电离出的c(OH-),据此解答;
②根据题意知,HA的酸性比碳酸强,NH4A溶液为中性,说明铵根离子和该酸根离子水解程度相同,由此得知铵根离子水解程度小于碳酸根离子,所以(NH4)2CO3中溶液呈碱性;根据铵根离子的水解程度判断溶液酸碱性的大小,溶液浓度越稀,盐的水解程度越大.
解答 解:①盐溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-8}}$=10-6 mol/L,0.1mol•L-1NaOH溶液中c(H+)等于由水电离出的氢氧根离子浓度,即c(H+)=c水电离(OH-)=$\frac{1{0}^{-14}}{0.1}$=10-13 mol/L,所以混合液中由水电离出的OH-浓度与0.1mol•L-1NaOH溶液中由水电离出的OH-浓度之比=10-6 mol/L:10-13 mol/L=107:1,
故答案为:107:1;
②将HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性比碳酸的强,NH4A溶液为中性,说明相同条件下,氨水和HA的电离程度相同,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,所以溶液的pH>7;
NH4Cl是强酸弱碱盐,铵根离子水解导致溶液呈酸性;
NH4A溶液中阴阳离子的水解程度相等,所以溶液呈中性,溶液的pH值大于氯化铵;
NH4HCO3溶液中铵根离子的水解程度小于碳酸氢根离子的水解程度,溶液呈碱性;
(NH4)2CO3溶液中碳酸根的水解程度更大,pH值最大,
则相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为:c>a>b>d,
故答案为:>;c>a>b>d.
点评 本题考查溶液酸碱性的定性判断及溶液pH的计算,题目难度中等,是对学生综合能力的考查,判断HA与碳酸酸性强弱是关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 299 | B. | 598 | C. | 587 | D. | 447 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=10时,溶液中有NH4+、Al3+、SO42-,且c ( NH4+)>c ( Al3+) | |
| B. | x=10时,溶液中有NH4+、AlO2-、SO42-,且c ( NH4+)>c ( SO42-) | |
| C. | x=30时,溶液中有Ba2+、AlO2-、OH-,且c ( OH-)<c ( AlO2-) | |
| D. | x=30时,溶液中有Ba2+、Al3+、OH-,且c ( OH-)=c ( Ba2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应①说明SO2具有漂白性,反应②说明SO2具有酸性 | |
| B. | 反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2 | |
| C. | 反应③④⑤均属于氧化还原反应 | |
| D. | 工业上可利用反应②和反应④回收SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 未氧化前合金的质量为5.44g | B. | V=448,它是H2和SO2的混合气体 | ||
| C. | 样品中CuO的质量为4.0g | D. | 滤液A中的阳离子为Fe2+、Fe3+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


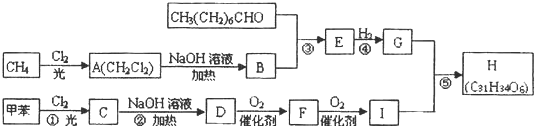
 ,F
,F .
. 、
、 、
、 、
、 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | Cu溶于稀HNO3:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Mg2+、Cl-、CH3COO- | B. | Na+、K+、SO42-、Cl- | ||
| C. | Na+、Cu2+、SO42-、NO3 | D. | NH4+、Na+、CO32-、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com