
【题目】氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理后的排放情况。
I、实验室通过如图所用的装置制备Na2S2O3
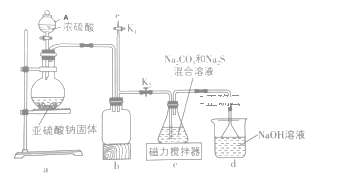
(1)仪器A的名称___,使用前注意的事项___。
(2)b装置的作用是___。
(3)装置a中发生反应的化学方程式____。
(4)反应开始后,c中先有淡黄色浑浊产生,此浑浊物为___(填化学式);反应后剩余的SO2全部被d中的氢氧化钠溶液吸收,若恰好生成酸式盐,反应后的溶液呈___(“酸”或“碱”)性,原因是___。
II、已知:废水中氰化钠的最高排放标准为0.50mg/L。
(1)向氰化钠溶液中通入少量CO2能发生反应:NaCN+CO2+H2O=HCN+NaHCO3,浓度相同①NaCN、②Na2CO3、③NaHCO3三种溶液pH值由大到小的顺序(用序号表示):___。
(2)工业上常用碱性氯化法处理含氰废水,其原理如下:第一步,NaCN与NaClO反应,生成NaOCN和NaCl;第二步,NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。某工厂含氰废水中NaCN的含量为1.47mg/L,处理10m3这样的废水,理论上需要5mol/LNaClO溶液___L处理后才可以进行排放。
【答案】分液漏斗 检验是否漏液 作安全瓶,防止倒吸 Na2SO3+H2SO4=Na2SO3+SO2↑+H2O S 酸 HSO3-的电离大于水解 ②①③ 0.15
【解析】
I、(1)仪器A的名称是分液漏斗;分液漏斗使用前需要注意检查是否漏液,避免发生实验安全事故;
(2)根据装置图和气体压强变化,装置b能作安全瓶,防止倒吸;
(3)a装置制备二氧化硫,其反应方程式为:Na2SO3+H2SO4=Na2SO3+SO2↑+H2O;
(4)二氧化硫与硫化钠在溶液中反应得到S,硫与亚硫酸钠反应得到Na2S2O3,c中先有浑浊产生,后又变澄清,此浑浊物为S;该酸式盐为NaHSO3,因HSO3-的电离大于水解,因此溶液呈酸性;
II、(1)根据强酸制弱酸的规律可知,酸性由大到小顺序为:H2CO3>HCN>HCO3-,根据越弱越水解,浓度相同①NaCN、②Na2CO3、③NaHCO3三种溶液pH值由大到小的顺序为:②①③;
(2)根据第一步和第二步的总反应可知,整个反应中氧化剂为NaClO,还原剂为NaCN,C由+2价升高到+4价,N元素化合价从-3价升高到0价,即1molNaCN失去5mol电子,1mol次氯酸钠得到2mol电子,根据得失电子守恒可列出关系式:
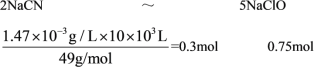
理论上需要5mol/LNaClO溶液为![]() =0.15L。
=0.15L。


科目:高中化学 来源: 题型:
【题目】已知气态烃A的密度是相同状况下氢气密度的14倍,有机物A~E能发生如图所示一系列变化,则下列说法错误的是

A. A分子中所有原子均在同一平面内
B. A→B所用试剂为![]()
C. 分子式为![]() 的酯有3种
的酯有3种
D. 等物质的量的B、D分别与足量钠反应生成气体的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废旧电池材料的主要成分为钴酸锂(LiCoO2),还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到Co2O3和锂盐。
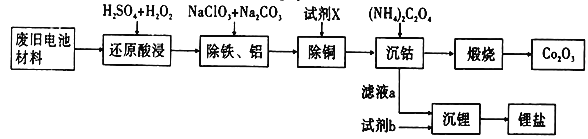
已知:CoC2O4·2H2O微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的C2O42-离子生成Co(C2O4)n2(n-1)-而溶解。
(1)“还原酸浸”过程中钴酸锂反应的离子方程式________________________________________;温度通常控制在40℃以下的原因是_______________________________________________。
(2)“除铝铁”过程的两种试剂的作用分别是____________________,______________________。
(3)“除铜”所用试剂X为H2S,试写出该反应的离子方程式______________________________。
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:
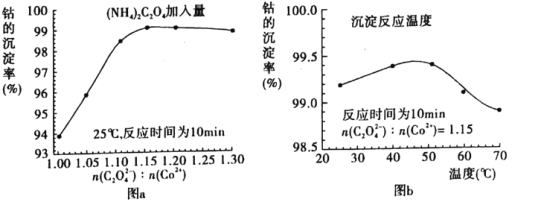
①随n(C2O42-):N(Co2+)比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因________________________________________________________________________。
②沉淀反应时间为10 min,温度在50℃以上时,随温度升高而钴的沉淀率下降的可能原因是_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近有科学家发现正丁烷(![]() )脱氢或不完全氧化也可制得1,3-丁二烯(
)脱氢或不完全氧化也可制得1,3-丁二烯(![]() ),已知热化学方程式如下:( )
),已知热化学方程式如下:( )
①![]() =
=![]()
![]()
②![]() =
=![]()
![]()
③![]() =
=![]()
![]()
下列说法正确的是( )
A.由②可知,正丁烷(![]() )的燃烧热为
)的燃烧热为![]()
B.由①和②可推知:![]() =
=![]()
![]()
C.![]() =
=![]()
![]()
D.由①和②可知,同质量的正丁烷(![]() )转变为1,3-丁二烯(
)转变为1,3-丁二烯(![]() )所需要的能量相同
)所需要的能量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设计了一种可以循环利用人体呼出的CO2并提供O2的装置,总反应方程式为2CO2=2CO+O2。下列说法正确的是( )
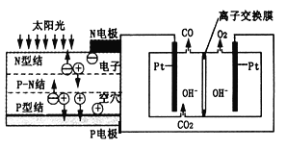
A. 由图分析N电极为电池的正极
B. 阴极的电极反应为CO2+H2O+2e-=CO+2OH-
C. OH-通过离子交换膜迁向左室
D. 反应完毕,该装置中电解质溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
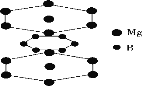
【题目】下面的排序不正确的是( )
A.晶体熔点高低:对羟基苯甲醛>邻羟基苯甲醛
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.硼镁超导物质的晶体结构单元如图所示,则这种超导材料的化学式为MgB2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究苯与溴反应生成溴苯的实验可用如图所示装置,分析装置并完成下列题目:
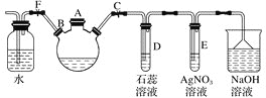
(1)关闭止水夹F,打开止水夹C,由A口向装有少量苯的三口烧瓶中加入过量液溴,再加入少量铁屑,塞住A口,则三口烧瓶中发生反应的有机化学方程式为______________________。
(2)D、E试管内出现的现象分别为:D.______, E.__________。
(3)待三口烧瓶中的反应进行到仍有气泡冒出时,松开止水夹F,关闭止水夹C,可以看到的现象是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
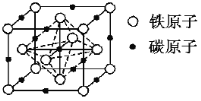
【题目】镁、铝、铁是三种重要金属,它们的单质和化合物应用十分广泛。回答下列问题:
(1)镁、铝第一电离能大小的关系是I1(Mg)___I1(Al),金属镁、铝熔点大小关系是Mg___Al。(填“大于”、“等于”或“小于”)
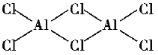
(2)氯化铝加热时易升华,实验测得铝元素与氯元素形成化合物的实际组成为Al2Cl6,其结构简式如图所示。其中处于中间的Cl原子杂化轨道类型为___杂化,分子中所有原子___(能、不能)在同一平面上。
(3)硝酸铁和尿素在乙醇中生成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁]。产物是一种重要的配合物,用作有机铁肥,简称铁氮肥。基态Fe3+的核外电子排布式为___。尿素分子中σ键与π键的数目之比为___。NO3-的空间构型为___,经测定N2O5晶体中存在NO2+和NO3-,NO2+中氮原子为___杂化。
(4)碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构如图所示。晶体中与相邻铁原子距离相等且最近的铁原子有___个,该物质的化学式为___。若晶体密度为dg·cm-3,则晶胞中最近的两个碳原子的距离为___pm(阿伏加德罗常数的值为NA表示,写出简化后的计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com