
分析 (1)煤燃烧产生的烟气含二氧化硫及固体颗粒物;
(2)需通入一段时间的二氧化碳,提高钙离子浓度;亚硫酸氢钙被足量氧气快速氧化成硫酸钙,还生成硫酸;
(3)增加化石燃料的使用、大力发展火力发电均不能减少二氧化碳的排放;
(4)等物质的量的CO2和CH4在催化剂和加热的条件下恰好发生化合反应生成一种常见有机物为乙酸,产物只有一种;
(5)处理1m3该烟气得到的CaSO4加入燃料反应器中与甲烷充分反应,消耗甲烷7g,消耗的二氧化硫为$\frac{\frac{7g}{16g/mol}}{1000L}$×64g/mol,以此计算该烟气中SO2的去除率.
解答 解:(1)煤燃烧产生的烟气含二氧化硫及固体颗粒物,二氧化硫可导致酸雨发生,固体颗粒导致粉尘污染,而光化学烟雾与N的氧化物排放有关,水体富营养化与N、P化合物排放有关,故答案为:BC;
(2)需通入一段时间的二氧化碳,其目的是增大溶液中Ca2+的浓度,提高脱硫效率;亚硫酸氢钙被足量氧气快速氧化成硫酸钙,还生成硫酸,反应为Ca(HSO3)2+O2=CaSO4+H2SO4,
故答案为:增大溶液中Ca2+的浓度,提高脱硫效率;Ca(HSO3)2+O2=CaSO4+H2SO4;
(3)增加化石燃料的使用、大力发展火力发电均不能减少二氧化碳的排放,而植树造林,增大植被面积及采用节能技术均可降低大气中CO2浓度,
故答案为:BC;
(4)等物质的量的CO2和CH4在催化剂和加热的条件下恰好发生化合反应生成一种常见有机物为乙酸,反应为CO2+CH4$\frac{\underline{催化剂}}{△}$CH3COOH,该反应优点为原子利用率高,无副产物产生,
故答案为:CO2+CH4$\frac{\underline{催化剂}}{△}$CH3COOH;原子利用率高,无副产物产生;
(5)处理1m3该烟气得到的CaSO4加入燃料反应器中与甲烷充分反应,消耗甲烷7g,消耗的二氧化硫为$\frac{\frac{7g}{16g/mol}}{1000L}$×64g/mol=2.8×10-2g/L,该烟气中SO2的去除率为$\frac{2.8×1{0}^{-2}}{3.2×1{0}^{-2}}$×100%=87.5%,故答案为:87.5%.
点评 本题考查三废处理及环境保护,为高频考点,把握物质的性质、环境保护及化学反应的应用等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 洗涤烧杯和玻璃棒的洗涤液未转入容量瓶中 | |
| C. | 往烧杯中转移溶液时有少量液体溅出 | |
| D. | 定容时俯视 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
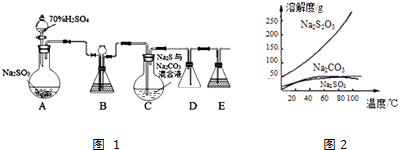
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | H2 | CO2 | CH3 OH | H2 O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |
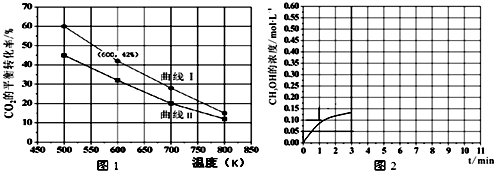
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe、Cu、Zn原子最外层电子数依次增多 | |
| B. | N、O、F元素最高正化合价依次升高 | |
| C. | P、S、Cl第一电离能依次增大 | |
| D. | Na、K、Rb的金属性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
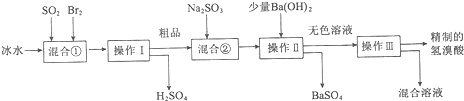
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③④⑤ | C. | 只有① | D. | ①② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com