
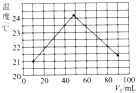
 某化学兴趣小组要完成中和热的测定.
某化学兴趣小组要完成中和热的测定.| 实验编号 | 实验用品 | 溶液温度 | 中和热 | |
| t2-t1 | △H | |||
| ① | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.3℃ | ? |
| ② | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.5℃ | |
分析 (1)根据中和热测定的实验步骤选用需要的仪器,然后判断还缺少的仪器;
(3)①中和热测定实验中需要温度计测量开始时酸、碱的温度和反应后的最高温度;
②先判断温度差的有效性,根据公式Q=cm△T来求出生成0.025mol的水放出热量,根据中和热的概念求出中和热,最后写出热化学方程式;
③从图示观察的起始温度即为实验时的温度;
(4)a.依据Q=m•c•△T来逐项分析;
A.实验装置保温、隔热效果差,热量散失,导致反应后的温度低;
B.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,导致开始时温度偏高;
C.量取NaOH溶液的体积时仰视读数,导致放出的热量多;
D.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失,导致反应后的温度低;
b.根据中和热的概念和实质来回答;根据弱电解质电离吸热.
解答 解:(1)中和热的测定过程中,需要用量筒量取酸溶液、碱溶液的体积,需要使用温度计测量温度,环形玻璃棒搅拌棒搅拌混合溶液,所以还缺少环形玻璃棒搅拌棒和量筒;
故答案为:环形玻璃棒搅拌;量筒;
(3)①t1为氢氧化钠溶液和盐酸的初始温度的平均值,则t2的意义是反应后的最高温度;
故答案为:反应后的最高温度;
②50mL0.50mol/L的盐酸和50mL0.55mol/L的NaOH溶液混合,氢氧化钠过量,反应生成了0.025mol水,
第1次反应前后温度差为:3.3℃;第2反应前后温度差为:3.5℃,均有效,温度差的平均值为3.4℃,50mL0.50mol/L的盐酸和50mL0.55mol/L的NaOH溶液的质量和为m=100mL×1g/mL=100g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×3.4℃=1.4212kJ,即生成0.025mol的水放出热量1.4212kJ,所以生成1mol的水放出热量为1.4212kJ×$\frac{1mol}{0.025mol}$=-56.848 kJ,即该实验测得的中和热△H=-56.848 kJ•mol-1,NaOH溶液与HCl溶液反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.848 kJ•mol-1;
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.848 kJ•mol-1;
③根据实验图象所示,22℃是加入10mL氢氧化钠或盐酸反应后的温度,可知该实验开始时温度一定是低于22℃;
故答案为:低于;
(4)a.A.由于大小烧杯间空隙过大,填充了很多的泡沫塑料,热量散失,导致反应后的温度低,△T偏小,由Q=m•c•△T,可知测量结果偏低,故A错误;
B.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,导致开始时温度偏高,△T偏小,由Q=m•c•△T,可知测量结果偏低,故B错误;
C.量取NaOH溶液的体积时仰视读数,放出的热量多,△T偏大,由Q=m•c•△T,可知测量结果偏高,故C正确;
D.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失,导致反应后的温度低,△T偏小,由Q=m•c•△T,可知测量结果偏低,故D错误;
故选C.
b.中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关,所以用用60mL0.50mol/L盐酸跟50mL0.55mol/L的NaOH溶液进行反应,测得的中和热的数值无影响;醋酸为弱酸,电离过程为吸热过程,所以用醋酸代替HCl,反应放出的热量偏小,中和热的数值会偏小;
故答案为:相等;有.
点评 本题考查中和热的测定原理,题目难度中等,注意理解中和热的概念是解题的关键.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.35mol | B. | 0.7mol | C. | 0.3mol | D. | 0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质的盐析是可逆过程 | |
| B. | 变性是蛋白质的凝固 | |
| C. | 盐析和变性都能够改变蛋白质的性质 | |
| D. | 盐析和变性都可以通过加入盐来实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素互为同分异构体 | |
| B. | 蛋自质和纤维素水解的最终产物都是氨基酸 | |
| C. | 油脂、纤维素、淀粉在一定条件下均可发生水解反应 | |
| D. | 油脂、纤维素、淀粉都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入醋酸钠固体 | B. | 加入盐酸 | C. | 加入蒸馏水 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,A分子中最多在同一平面的原子数为16;
,A分子中最多在同一平面的原子数为16;

 +H2O→
+H2O→


 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com