


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
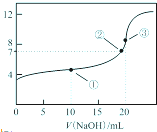 常温下,用 0.1000mol?L-1NaOH溶液滴定 20.00mL 0.1000mol?L-1CH3COOH溶液所得滴定曲线如图.下列说法不正确的是( )
常温下,用 0.1000mol?L-1NaOH溶液滴定 20.00mL 0.1000mol?L-1CH3COOH溶液所得滴定曲线如图.下列说法不正确的是( )| A、点①所示溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| B、点②所示溶液中:c(Na+)=c(CH3COO-) |
| C、点③所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) |
| D、滴定过程中可能出现:c(CH3COOH)>c(H+)>c(CH3COO-)>c(Na+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

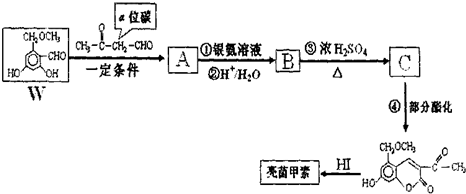
查看答案和解析>>
科目:高中化学 来源: 题型:
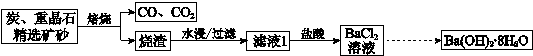
| 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | |
| Ba(OH)2?8H2O | 2.48 | 3.89 | 8.22 | 20.9 | 101 |
| NaOH | 98.0 | 109 | 129 | 174 | 314 |
| NaCl | 35.8 | 35.9 | 36.4 | 37.1 | 38.0 |
| BaCl2 | 33.5 | 35.8 | 40.8 | 46.2 | 52.5 |

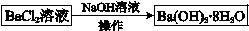
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.09g |
| B、1.20 g |
| C、1.36g |
| D、1.63g |
查看答案和解析>>
科目:高中化学 来源: 题型:
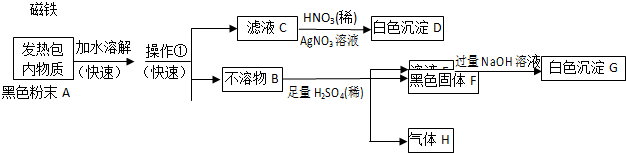
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用试管夹从试管底由下往上夹住距离管口约三分之一处,手持试管夹长柄末端,进行加热 |
| B、制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中 |
| C、把玻璃管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻璃管插入端,缓慢旋进塞孔中 |
| D、实验时不慎打破温度计水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
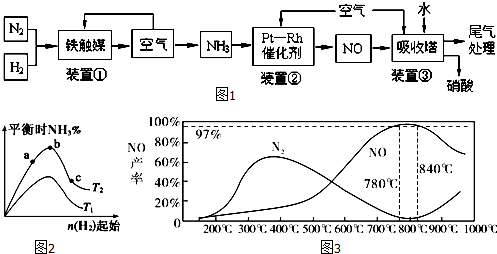
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com