
分析 (1)生成的沉淀为硫酸钡,根据反应Ba2++SO42-=BaSO4↓计算出氢氧化钡的物质的量;
(2)加入硫酸发生中和反应,根据氢氧化钡及硫酸的物质的量计算出氢氧化钠的物质的量,然后根据c=$\frac{n}{V}$计算出原混合溶液中NaOH的物质的量浓度.
解答 解:(1)一份加入过量的Na2SO4溶液,充分反应后得到沉淀2.33g,该沉淀为硫酸钡,其物质的量为:n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,根据反应Ba2++SO42-=BaSO4↓可知每份氢氧化钡的物质的量为0.01mol,则原混合液中Ba(OH)2的物质的量为:0.01mol×2=0.02mol,
故答案为:0.02 mol;
(2)另一份加入50ml.0.1mol/LH2SO4溶液,充分反应后溶液中c(OH-)为0.3mol/L(此时溶液的体积为100mL),设每份溶液中氢氧化钠的物质的量为x,则:x+0.01mol×2-0.1mol/L×2×0.05L=0.3mol/L×0.1L,解得:x=0.01mol,
所以NaOH的物质的量浓度为:c(NaOH)=$\frac{0.02mol}{0.05L}$=0.4mol/L,
故答案为:0.4 mol/L.
点评 本题考查了物质的量的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握物质的量与物质的量浓度之间的关系,试题培养了学生的化学计算能力.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 27 mL 4℃的水中所含分子数约为1.5 NA个 | |
| B. | 电解精炼铜时,阳极减少6.4 g,则转移电子数一定是0.2 NA个 | |
| C. | 标准状况下,22.4L乙烯中共价键数目为8 NA | |
| D. | pH=1的硫酸溶液所含的H+数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
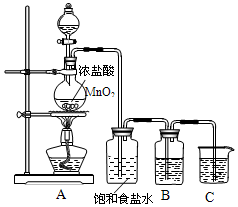 实验室制取氯气的装置如图:
实验室制取氯气的装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
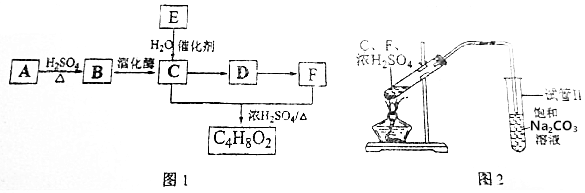
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:H2(g)+F2(g)═2HF(g)△H=-546.6 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2mol 液态氟化氢放出的热量小于546.6 kJ | |
| B. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g) 置于密闭容器中充分反应生成NH3(g)放热19.3 kJ.其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则H2SO4(aq)+Ca(OH)2(aq)═CaSO4(s)+2H2O(l)△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法计算 | B. | 2.8g | C. | 5.6g | D. | 11.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
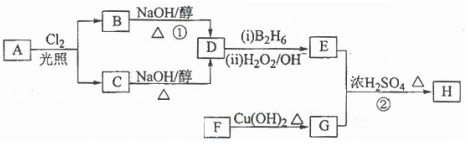
 ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com