
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下: 
已知:
生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是 . 盐酸溶解MnCO3的化学方程式是 .
(2)向溶液1中加入双氧水时,反应的离子方程式是 .
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+ , 反应的离子方程式是 .
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为: Mn2++ClO3﹣+=++ .
(5)将MnCl2转化为MnO2的另一种方法是电解法. ①生成MnO2的电极反应式是
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2 . 检验Cl2的操作是 .
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是 .
【答案】
(1)增大接触面积,提高反应速率;MnCO3+2HCl=MnCl2+CO2↑+H2O
(2)2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+
(3)MnS+Cu2+=Mn2++CuS
(4)5;2;4H2O;Cl2↑;5MnO2;8H+5Mn2++2ClO3﹣+4H2O=Cl2↑+5MnO2+8H+
(5)Mn2+﹣2e﹣+2H2O=MnO2+4H+;将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成;其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl﹣)],有利于Mn2+放电(不利于Cl﹣放电)
【解析】解:菱锰矿用盐酸酸浸,MnCO3、FeCO3、Cu2(OH)2CO3与盐酸反应,SiO2不与盐酸反应,过滤得到滤渣1为SiO2 , 滤液1中含有氯化镁、氯化亚铁、氯化铜及剩余的HCl,向滤液中加入生石灰,调节溶液pH=4,加入过氧化氢将溶液中Fe2+氧化为Fe3+ , 在PH=4时氧化得到Fe3+转化为Fe(OH)3沉淀,过滤除去,滤液2中加入MnS,将溶液中Cu2+转化为CuS沉淀过滤除去,滤液3中为MnCl2 , 系列转化得到MnO2 . (1)将菱锰矿粉碎,可以增大接触面积,提高反应速率;碳酸镁与盐酸反应生成氯化镁、二氧化碳与水,反应方程式为:MnCO3+2HCl=MnCl2+CO2↑+H2O, 所以答案是:增大接触面积,提高反应速率;MnCO3+2HCl=MnCl2+CO2↑+H2O;(2)加入过氧化氢将溶液中Fe2+氧化为Fe3+ , 在PH=4时氧化得到Fe3+转化为Fe(OH)3沉淀,根据电荷守恒有氢离子生成,反应离子方程式为:2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+ ,
所以答案是:2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+;(3)MnS与氯化铜反应转化更难溶的CuS,同时得到氯化镁,反应离子方程式为:MnS+Cu2+=Mn2++CuS,
所以答案是:MnS+Cu2+=Mn2++CuS;(4)用酸化的NaClO3溶液将MnCl2氧化得到MnO2 , Mn元素发生氧化反应,则Cl元素发生还原反应生成Cl2 , 由于在酸性条件下反应,根据电荷守恒可知,生成物中有H+生成,根据H元素守恒,可知反应物中缺项物质为H2O,配平后离子方程式为:5Mn2++2ClO3﹣+4H2O=Cl2↑+5MnO2+8H+ ,
所以答案是:5Mn2++2ClO3﹣+4H2O=Cl2↑+5MnO2+8H+;(5)①由题意可知,Mn2+转化为MnO2 , 发生氧化反应,由O元素守恒可知有水参加反应,由电荷守恒可知应有H+生成,电极反应式为:Mn2+﹣2e﹣+2H2O=MnO2+4H+ ,
所以答案是:Mn2+﹣2e﹣+2H2O=MnO2+4H+;②生成氯气发生氧化反应,在阳极产生,检验Cl2的操作是:将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成,
所以答案是:将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成;③Mn2+、Cl﹣都在阳极放电,二者为竞争关系,增大Mn2+浓度[或增大c(Mn2+)/c(Cl﹣)],有利于Mn2+放电(不利于Cl﹣放电),
所以答案是:其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl﹣)],有利于Mn2+放电(不利于Cl﹣放电).


科目:高中化学 来源: 题型:
【题目】Mg﹣AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙述正确的是( )
A.正极反应式为Mg﹣2e﹣═Mg2+
B.正极反应式为Ag+e﹣═Ag
C.电池放电时Cl﹣由负极向正极迁移
D.负极会发生副反应Mg+2H2O═Mg(OH)2+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能与稀硫酸反应,又能与NaOH溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3
A. ③④ B. ①②③④ C. ①③④ D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 摩尔是国际单位制的一个基本物理量
B. 同温同压下,气体的体积之比等于对应的物质的量之比
C. 气体摩尔体积是指任何条件下1mol气体所占的体积,都约为22.4L
D. 任何物质的摩尔质量等于其对应的相对分子质量或相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种高效、广谱、安全的杀菌、消毒剂,易溶于水.制备方法如下:
(1)步骤Ⅰ:电解食盐水制备氯酸钠.用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42﹣等杂质.在除杂操作时,往粗盐水中先加入过量的(填化学式),至沉淀不再产生后,再加入过量的和NaOH,充分反应后将沉淀一并滤去.
(2)步骤Ⅱ:将步骤Ⅰ得到的食盐水在特定条件下电解得到氯酸钠(NaClO3),再将它与盐酸反应生成ClO2与Cl2 , ClO2与Cl2的物质的量比是 .
(3)学生拟用图1所示装置模拟工业制取并收集ClO2 , 用NaClO3和草酸(H2C2O4)恒温在60℃ 时反应制得. 
反应过程中需要对A容器进行加热,加热的方式为;加热需要的玻璃仪器除酒精灯外,还有;
(4)反应后在装置C中可得亚氯酸钠(NaClO2)溶液.已知NaClO2饱和溶液在温度低于38℃ 时,析出的晶体是NaClO23H2O,在温度高于38℃时析出的是NaClO2 . 根据图2所示NaClO2的溶解度曲线,请完成从NaClO2溶液中制得NaClO23H2O的操作步骤: ①;②;③洗涤;④干燥.
(5)目前我国已成功研制出利用NaClO2制取二氧化氯的新方法,将Cl2通入到NaClO2溶液中.现制取270kg二氧化氯,需要亚氯酸钠的质量是 .
(6)ClO2和Cl2均能将电镀废水中的剧毒CN﹣氧化为无毒物质,自身被还原为Cl﹣ . 处理含CN﹣相同量的电镀废水,所需Cl2的物质的量是ClO2的倍.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A,其蒸汽对氢气的相对密度是42,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢.
(1)A的结构简式为 , 名称为 .
(2)A中的碳原子是否都处于同一平面?(填“是”或“不是”);A分子是否存在顺反异构体(填“是”或“否”).
(3)已知A、B、C有如下转化关系:A ![]() B
B ![]()
![]() 则反应②的化学方程式为;反应的类型是 .
则反应②的化学方程式为;反应的类型是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,将盛有20mL NO2和O2的混合气体的大试管倒立在水槽中,水面上升至一定位置后不再变化,此时还有3mL气体,则原混合气体中的NO2的体积可能是( )
A.17.8 mL
B.14.8 mL
C.12.6 mL
D.12.4 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验. 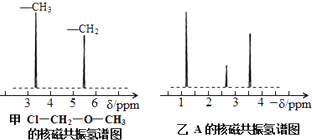
(1)分子式的确定
将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2 , 消耗氧气6.72L(标准状况下).则该物质的实验式是;
(2)质谱仪测定有机物A的相对分子质量为46,则该物质的分子式;
(3)结构式的确定
预测A的可能结构并写出结构简式 .
(4)性质实验
核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:甲基氯甲基醚(Cl﹣CH2﹣O﹣CH3)有两种氢原子(见图甲).经测定,有机物A的核磁共振氢谱如图乙所示,则A的结构简式为 .
(5)A在一定条件下脱水可生成B,B可合成用于食品包装的塑料C,请分别写出转化反应化学方程式:
A→B:;
B→C: .
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com