
分析 (1)计算Na2X的物质的量,再根据M=$\frac{m}{n}$计算Na2X的摩尔质量,进而计算X的相对原子质量,确定X为何种元素,书写化学式;
(2)氯气溶于水,在水中发生Cl2+H2O?H++Cl-+HClO,HClO为若电解质,则溶液中存在的分子有H2O、Cl2、HClO等,存在的离子有:H+、Cl-、OH-、ClO-等,根据微粒的性质来回答.
解答 解:(1)Na2X中含有0.4mol Na+,Na2X的物质的量为0.2mol,则Na2X的摩尔质量=$\frac{12.4g}{0.2mol}$=62g/mol,摩尔质量在数值上等于其相对分子质量,钠原子的相对原子质量是23,所以X的相对原子质量是62-23×2=16,X为氧原子,该物质的化学式为Na2O,
故答案为:62g/mol;62;16;Na2O;
(2)氯水中存在的分子有H2O、Cl2、HClO等,存在的离子有:H+、Cl-、OH-、ClO-等.
①使氯水呈黄绿色的是Cl2,故答案为:Cl2;
②能使硝酸银溶液产生白色沉淀的是Cl-,故答案为:Cl-;
③能使紫色石蕊试液显红色的是H+,故答案为:H+;
④能使湿润的红纸褪色的是HClO,故答案为:HClO;
⑤能使无水硫酸铜变蓝的是H2O,故答案为:H2O;
⑥能与碳酸氢钠溶液反应放出气体的是H+,故答案为:H+.
点评 本题考查氯水成分,题目难度不大,本题注意把握氯气与水反应的性质以及次氯酸的性质.


科目:高中化学 来源: 题型:实验题
 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
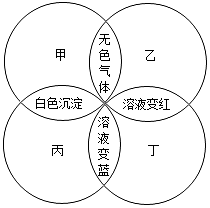 甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如图所示.请回答:
甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
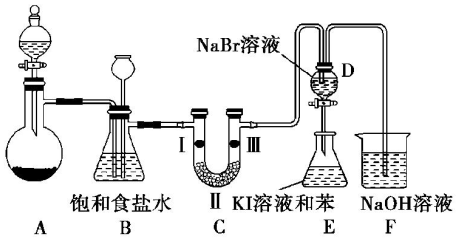
| a | b | c | |
| Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
 .打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象不能( 填“能”或“不能”)说明Br2的氧化性大于I2.
.打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象不能( 填“能”或“不能”)说明Br2的氧化性大于I2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 据报道,一定条件下 Fe2O3可被甲烷还原为“纳米级”的金属铁.其反应为:Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g)
据报道,一定条件下 Fe2O3可被甲烷还原为“纳米级”的金属铁.其反应为:Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:25℃时Ksp(BaSO4)=1.0×10-10.该温度下,CaSO4悬浊液中,c(Ca2+)与c(SO42-)的关系如图所示,下列叙述正确的是( )
已知:25℃时Ksp(BaSO4)=1.0×10-10.该温度下,CaSO4悬浊液中,c(Ca2+)与c(SO42-)的关系如图所示,下列叙述正确的是( )| A. | 向a点的溶液中加入等物质的量固体Na2SO4或Ca(NO3)2,析出的沉淀量不同 | |
| B. | a、b、c、d四点对应的体系中,d点体系最稳定 | |
| C. | 升高温度后,溶液可能会由a点转化为b点 | |
| D. | 反应Ba2+(aq)+CaSO4(s)?BaSO4(s)+Ca2+(aq)的平衡常数K=9×104 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com