
【题目】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
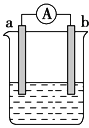
(1)当电极a为Al,电极b为Mg,电解质溶液为稀硫酸时,该电池的正极为________ (填元素符号),负极的电极反应式为:__________________。
(2)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该电池的正极为____(填元素符号),负极的电极反应式为:__________________ 。
(3)铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为硫酸。该电池总反应式为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
①该蓄电池放电时,电解质溶液中阴离子移向_____(填“正极”或“负极”);正极附近溶液的酸性_________(填“增强”、“减弱”或“不变”)放电时,负极的电极反应式为:__________________(用离子方程式表示)。
②实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得0.050 mol Cl2,这时电池内消耗的H2SO4的物质的量至少是____________。氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为KOH溶液,则氢氧燃料电池的负极反应式为______________。该电池工作时,外电路每流过1 mol e-,消耗标况下氧气_________L。
【答案】 Al Mg-2 e-==Mg2+ Mg Al+ 4OH- -3 e- == AlO2- +2H2O 负极 减弱 Pb - 2e- +SO42-=PbSO4 0.10 mol H2 - 2e- +2OH-= 2H2O(或 2H2 - 4e- +4OH-= 4H2O) 5.6
【解析】(1)Al、Mg、硫酸溶液可构成原电池,镁比铝活泼,镁为负极,铝为正极,负极上镁失去电子,正极上水中的氢离子得到电子,发生电池反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为: Al;Mg-2 e-==Mg2+;
(2)Al、Mg、NaOH溶液可构成原电池,Al为负极,Mg为正极,负极上Al失去电子,正极上水得到电子生成氢气和氢氧根离子,发生电池反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为: Mg;Al+ 4OH- -3 e- == AlO2- +2H2O;
(3)①该蓄电池放电时是原电池,在原电池中,电解质溶液中阴离子移向负极;该电池工作时,铅蓄电池正极为PbO2,PbO2得电子发生还原反应,电极反应为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,正极附近溶液的酸性减弱;放电时,负极铅失电子发生氧化反应,负极的电极反应式为Pb - 2e- +SO42-=PbSO4,故答案为:负极;减弱;Pb - 2e- +SO42-=PbSO4;
②根据电子转移守恒,结合负极:Pb+SO42-=PbSO4+2e-,可知生成0.05mol氯气时,转移电子0.1mol,参加反应Pb的物质的量![]() =0.05mol,由正极、负极电极反应式可知,电池总反应为:PbO2+Pb+2H2SO4=2PbSO4+2H2O,故消耗硫酸至少为0.05mol×2=0.1mol;燃料与氧气燃烧的总化学方程式为2H2+O2=2H2O,电解质溶液呈碱性,负极上氢气失电子生成水,则负极的电极方程式为2H2+4OH--4e-=4H2O;该电池中正极上是氧气发生得电子的还原反应,其电极反应为:O2+2H2O+4e-=4OH-,则外电路每流过1mol e-,消耗氧气为
=0.05mol,由正极、负极电极反应式可知,电池总反应为:PbO2+Pb+2H2SO4=2PbSO4+2H2O,故消耗硫酸至少为0.05mol×2=0.1mol;燃料与氧气燃烧的总化学方程式为2H2+O2=2H2O,电解质溶液呈碱性,负极上氢气失电子生成水,则负极的电极方程式为2H2+4OH--4e-=4H2O;该电池中正极上是氧气发生得电子的还原反应,其电极反应为:O2+2H2O+4e-=4OH-,则外电路每流过1mol e-,消耗氧气为![]() mol,所以氧气的体积为
mol,所以氧气的体积为![]() mol×22.4L/mol=5.6L,故答案为:H2 - 2e- +2OH-= 2H2O(或 2H2 - 4e- +4OH-= 4H2O);5.6。
mol×22.4L/mol=5.6L,故答案为:H2 - 2e- +2OH-= 2H2O(或 2H2 - 4e- +4OH-= 4H2O);5.6。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】有BaCl2 和AlCl3的混合溶液aL,将它平均分成两份。一份滴加稀硫酸,使钡离子完全沉淀,另一份滴加AgNO3溶液,使氯离子完全沉淀。反应中消耗x mol H2SO4,y mol AgNO3溶液。据此得知原混合溶液中的铝离子浓度为( ) mol/L。
A. (y-2x)/a B. (y-x)/a C. 2(y-2x)/3a D. (y-2x)/3a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.分子间作用力是分子间相互作用力的总称
B.分子间氢键的形成对物质的熔、沸点有影响
C.范德华力与氢键可同时存在于分子之间
D.氢键是一种特殊的化学键,它广泛地存在于自然界中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室现要配制浓度约480 mL、2 mol·L-1 的NaOH溶液:
(1)需要NaOH固体质量是________g。
(2)配制该溶液时,应选用________mL的容量瓶。
(3)在容量瓶上无需标记的是(______)
A.温度 B.刻度线 C.浓度 D.容积
(4)在配制过程需要用到的仪器有_______________________________________。
(5)在称取NaOH固体后,进行了下列操作:
①往容量瓶中小心加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管加蒸馏水,使溶液凹液面的最低处与刻度线相切;
②将容量瓶塞紧,并充分摇匀;
③将NaOH固体于烧杯中溶解,待其溶液冷却后,沿玻璃棒注入容量瓶中;
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。
上述操作步骤中,正确的顺序是__________________。(填序号)
(6)在实验过程中共有____________次用到玻璃棒?作用分别是什么?___________________________
(7)如图所示是该学生转移溶液的示意图,

图中的错误有①_____________________________;
②_____________________________。
(8)若实验过程中出现了如下情况,应如何处理?
①加蒸馏水时不慎超过了刻度线:______________________________
②向容量瓶中转移溶液时,不慎有液滴掉在容量瓶外面:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、U、W是原子序数依次增大的前四周期元素。其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元索形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子。请回答下列问题:
(1)X、Y、Z的第一电离能从大到小的顺序是_______ (用元素符号表示,下同)。
(2)写出W的价电子排布式________ ,W同周期的元素中,与W原子最外层电子数相等的元素还有_______。
(3)根据等电子体原理,可知化合物XZ的结构式是______,YZ2-的VSEPR模型是________。
(4)X、Y、Z的简单氢化物的键角从大到小的顺序是________(用化学式表示),原因是____________________。
(5)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式_______,该物质硬度大,推测该物质为______晶体。其中Y元素的杂化方式是____________。
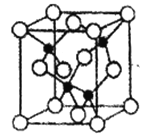
(6)U的晶体属立方晶系,其晶胞边长为405Pm,密度是2.70g·cm-3,通过计算确定其晶胞的类型________________(堆简单立方堆积、体心立方堆积或面心立方最密堆积)(己知:4053=6.64×107)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。
CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。
相关数据如下:
容器 编号 | 起始时各物质的物质的量/mol | 达平衡过程体系的能量变化 | |||
CO | H2O | CO2 | H2O | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中,不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 容器①中CO反应速率等于H2O的反应速率
D. 平衡时,两容器中CO2的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,在方框和括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案。
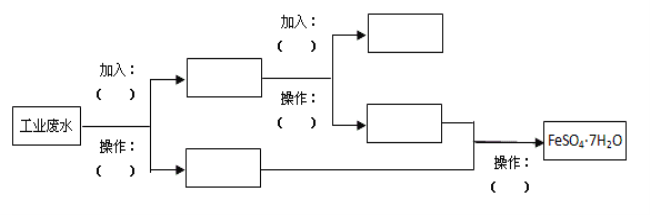
______________、________________、__________________、______________、_____________、______________、__________________、________________、_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在溶液中能大量共存的是( )
A. S2-、Na+、SO32-、H+ B. Na+、HCO3-、Cl-、OH-
C. Na+、Al3+、Cl-、SO42- D. H+、Fe2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A. SO2具有氧化性,常用于漂白秸秆、织物
B. 明矾水解形成Al(OH)3胶体,可用作水处理中的消毒剂
C. 白葡萄酒含维生素C 等多种维生素,通常添加微量SO2,以防止营养成分被氧化
D. 次氯酸有酸性,可用于自来水的杀菌消毒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com