
| A. | M一定是强电解质 | B. | M一定是弱电解质 | C. | M一定是某种盐 | D. | M一定是某种强碱 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
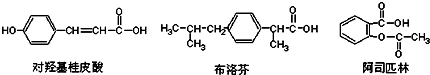
| A. | 三种有机物都能发生水解反应 | |
| B. | 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 | |
| C. | 三种物质中,其中有两种互为同分异构体 | |
| D. | 三种物质在一定条件下,均可以被氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
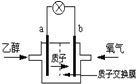 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )| A. | 电池工作时,1mol乙醇被氧化时就有6mol电子转移 | |
| B. | a极为电池的负极 | |
| C. | 电池工作时电流由b极沿导线经灯泡再到a极 | |
| D. | 电池正极的电极反应为:4H++O2+4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,溶液呈红色(Cl2) | |
| B. | 新制氯水使红色布条褪色(Cl2) | |
| C. | 将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-) | |
| D. | 向NaHCO3固体中加入新制的氯水,有无色气泡产生(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;32g甲在足量浓硝酸中反应转移的电子数为2NA;甲在足量氧气中充分灼烧的化学方程式为Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2.
;32g甲在足量浓硝酸中反应转移的电子数为2NA;甲在足量氧气中充分灼烧的化学方程式为Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com