
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ����ǿ�������Դ�����п�����Ӧ�õĹ���ǰ����
��1����֪��CH3OH(g)=HCHO(g)+H2(g) ��H=+84kJmol1��2H2(g)+O2(g)�T2H2O(g)��H=484kJmol1����ҵ�ϳ��Լ״�Ϊԭ����ȡ��ȩ����д��CH3OH(g)��O2(g)��Ӧ����HCHO(g)��H2O(g)���Ȼ�ѧ����ʽ______________��
��2����ҵ���ں����ܱ������пɲ������з�Ӧ�ϳɼ״�CO(g)+2H2(g)![]() CH3OH(g)��H
CH3OH(g)��H
�����жϸ÷�Ӧ�ﵽƽ��״̬��������_________(��ĸ���)��
A��2 ����(H2) = �� ��(CO)
B�����������ܶȲ���
C����������ƽ����Է�����������
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
E��������CO��H2��CH3OH��Ũ��֮��Ϊ1:2:1
F��CO��H2��CH3OH������֮��Ϊ1:2:1
��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ���÷�Ӧ��H_______0���������������

��һ���¶���,��4a mol H2��2a mol CO����2L���ܱ������У���ַ�Ӧ����CO��ת����Ϊ50������÷�Ӧ��ƽ�ⳣ��Ϊ_______________��
���𰸡�2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)��H=-316kJmol-1 CD �� ![]() L2mol-2
L2mol-2
��������
(1)���ݸ�˹���ɷ�����дCH3OH(g)��O2(g)��Ӧ����HCHO(g)��H2O(g)�Ȼ�ѧ����ʽ��
(2)�ٸ��ݷ�Ӧ�ﵽƽ��״̬�����������жϣ�����ͬѹǿ�£��¶�Խ�ߣ�COת����ԽС��˵�������¶ȣ�ƽ�����淴Ӧ�����ƶ����۸�������ʽ����ƽ�ⳣ����
(1)I.CH3OH(g)�THCHO(g)+H2(g)��H=+84kJmol-1����.2H2(g)+O2(g)�T2H2O(g) ��H=-484kJmol-1�����ݸ�˹���ɣ�����2+��ã�2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)��H=(84��2-484)kJmol-1=-316kJmol-1���ʴ�Ϊ��2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) ��H=-316kJmol-1��
(2)��A�����ݷ���ʽCO(g)+2H2(g)![]() CH3OH(g)��2v��(CO)=v��(H2)����2����(H2)=����(CO)����˵���÷�Ӧ�ﵽƽ��״̬����A����
CH3OH(g)��2v��(CO)=v��(H2)����2����(H2)=����(CO)����˵���÷�Ӧ�ﵽƽ��״̬����A����
B����Ӧǰ���������������䣬����������䣬����������ܶ�ʼ�ղ��䣬�ʻ��������ܶȲ��䲻��˵���÷�Ӧ�ﵽƽ��״̬����B����
C����Ӧǰ���������������䣬������������ʵ����ڱ仯����˻�������ƽ����Է����������䣬�ܹ�˵������������ʵ������䣬��˵���÷�Ӧ�ﵽƽ��״̬����C��ȷ��
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯���������Ũ�Ȳ��䣬��˵���÷�Ӧ�ﵽƽ��״̬����D��ȷ��
E��������CO��H2��CH3OH��Ũ��֮��Ϊ1��2��1������˵�������Ũ�Ȳ��䣬�ʲ���˵���÷�Ӧ�ﵽƽ��״̬����E����
F�����ݷ���ʽ��CO��H2��CH3OH������֮��ʼ��Ϊ1��2��1������˵������Ӧ���ʵ����淴Ӧ���ʣ��ʲ���˵���÷�Ӧ�ﵽƽ��״̬����F����
CD��ȷ���ʴ�Ϊ��CD��
����ͼ��֪����ͬѹǿ�£��¶�Խ�ߣ�CO��ת����Խ�ͣ�˵�������¶ȣ�ƽ�����淴Ӧ�����ƶ�����÷�ӦΪ���ȷ�Ӧ����H��0���ʴ�Ϊ������
�������⽨����������ʽ��
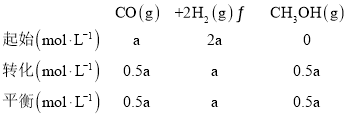
K=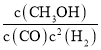 =
=![]() =
=![]() L2mol-2���ʴ�Ϊ��
L2mol-2���ʴ�Ϊ��![]() L2mol-2��
L2mol-2��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��R��X��T��Z��Q��Ԫ�����ڱ��е����λ�����±���ʾ,����R�����ڰ�����H2���һ��ϲ�������ը���������ж���ȷ����( )
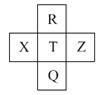
A.�ǽ�����:Z<T<X
B.R��Q�ĵ��������26
C.��̬�⻯���ȶ���:R<T<Q
D.����������ˮ���������:R>Q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ṥҵβ���е������NO��NO2������Ҫ�Ĵ�����Ⱦ��֮һ�����ð������������ѡ���Դ���ԭ����������Ҫ��Ӧԭ�����£�4NO+4NH3+O2![]() 4N2+6H2O��6NO2+8NH3
4N2+6H2O��6NO2+8NH3![]() 7N2+12H2O��
7N2+12H2O��
ij���᳧�ŷŵ�β���е���������ĺ���Ϊ2490mg/m3���������������״����������NO��NO2���ʵ�����Ϊ4��1����β���е��������백�������ǡ����ȫ��Ӧ��
��1��β���е����������ƽ����Է�������Ϊ___��
��2��β����NO�ĺ���Ϊ___mg/m3��
��3��Ҫ����5m3��β������Ҫ��������������Ϊ___L��
��һ�ִ�����������ķ��������ռ�������գ�����ΪNaNO2��NaNO3��H2O�����к�0.5mol���������β����ǡ�ñ�һ�������25%NaOH��Һ���ܶ�1.28g/cm3����ȫ���ա�
��4��NaOH��Һ�����ʵ���Ũ��Ϊ___mol/L�����Ϊ___mL��
��5����֪��Ӧ����Һ�к���0.35molNaNO2������β����NO��NO2��ƽ����ɼ�ΪNOx��ͨ��������x___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������þ��MgO2��������ϡ�ᣬ������������������⣬��ҽѧ�Ͽ���Ϊ����������ȡ�������þ��Ʒ�г������һ������MgO��ʵ���ҿ�ͨ�����ַ����ⶨ��Ʒ�й�����þ�ĺ�����ij�о�С��������ͼװ�òⶨһ����������Ʒ�й�����þ�ĺ�����
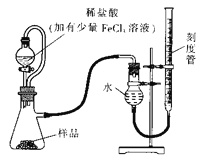
��1��ʵ��ǰ����еIJ����ǣ� _______��ϡ�����м�������FeCl3��Һ�������ǣ�_________��
��2���ú�ѹ��Һ©�����ŵ��У�
�� ___________��
�� ʹ��Һ©����Һ��˳�����¡�
ʵ�����ʱ�����ָ������£���_______����ƽ�ӿ̶��߶�����
ʵ���һ���ͨ���������ַ������ⶨ��Ʒ�й�����þ�ĺ�����
����I��ȡa g��Ʒ����������ϡ���ᣬ��ַ�Ӧ���ټ��� NaOH��Һ��Mg2��������ȫ�����ˡ�ϴ�Ӻ�����������գ����յõ�b g���塣
��3���������Ʒ�й�����þ����������_______ ���ú�a��b�ı���ʽ��ʾ����
������ȡ0.1 g��Ʒ����ij��������ƿ�У�����15 mL0.6 mol/LKI��Һ���������ᣬҡ�Ⱥ��ڰ�������5 min��Ȼ����0.1 mol/L Na2S2O3��Һ�ζ����ζ����յ�ʱ������28.5 mL Na2S2O3��Һ������֪��I2+2Na2S2O3��Na2S4O6+2NaI��
��4����ʵ���ڵζ�ǰ���������______��ָʾ�����жϵ���ζ��յ��������_____���������Ʒ�й�����þ����������Ϊ____��������λС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������FeO��Fe��Fe3O4�Ļ�����м���100mL 2 mol/L���ᣬǡ��ʹ�������ȫ�ܽ⣬�ų�224mL����״�������壬��������Һ�м���KSCN��Һ��Ѫ��ɫ���֡�����������CO�ڸ����»�ԭ��ͬ�����Ĵ˻����õ����������ǣ� ��
A.5.6 B.4.2 C.2.8 D.1.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������и���Һ�У�����һ���ܴ���������ǣ�������
A.pH=1����Һ�У�HCO3����NH4+��NO3����Ca2+
B.��ǿ������Һ�У�Na+��K+��AlO 2����Cl��
C.��ɫ��Һ�У�Fe3+��MnO4����Cl����H+
D.��ˮ�����c��H+��=1.0��10��12 molL��1����Һ�У�ClO����Na+��![]() ��K+
��K+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ�������Ϊ 10 mL �� 0.1 mol/LNaOH��Һ����μ���0.1mol/LCH3COOH��Һ��������ͼ��ʾ�������й�����Ũ�ȹ�ϵ�ıȽ��У��������
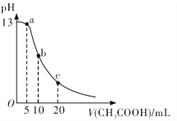
A. a�㴦��c( Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. b�㴦��c(CH3COOH)+c(H+ )=c(OH-)
C. c�㴦��c(CH3COOH)+c(CH3COO-)=2c(Na+)
D. NaOH��Һ��CH3COOH��Һ������Ȼ��ʱ��c( Na+)+c(H+)=c(OH-)+(CH3COO-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨһ���ڿ����е�ij�����ữ��FeSO4��Һ��Fe2+�������İٷ��ʣ�ijͬѧȷ��ȡpH=1������Fe2+��Fe3+��ˮ�⣩��FeSO4��Һ200mL���������BaCl2��Һ����ַ�Ӧ����ˡ�ϴ�ӡ�����õ�����28.0g������ȡͬ����FeSO4��Һ200mL�������м������NaOH��Һ������ʹ���ַ�Ӧ��������ȫ����Ϊ���ɫ���ˡ�ϴ�Ӳ��������ù��壬���յù���8.0g��
��1��д����Ӧ���漰�Ļ�ѧ����ʽ������3����__��__��__
��2��ͨ�����㣬��д�±���
c��H+�� | c��SO42���� | c��Fe2+��Fe3+�� |
__ | __ | __ |
ע��c��Fe2+��Fe3+����ʾFe2+��Fe3+���ܵ����ʵ�����Ũ��
��3������ԭ��Һ��Fe2+�������İٷ���__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��̽����â��Na2SO4��10H2O��CaOΪԭ���Ʊ�Na2CO3��
��1����CaOˮ������â���γ�Na2SO4��Ca(OH)2��H2O��Ԫ��ϵ����Ӧ����ˣ�����Һ��ͨ��CO2�������õ�Na2CO3����Ԫ��ϵ�з�Ӧ�����ӷ���ʽΪ�� SO42��+ Ca(OH)2(s)+2H2O![]() CaSO4��2H2O(s)+2 OH��
CaSO4��2H2O(s)+2 OH��
�÷�Ӧ��ƽ�ⳣ������ʽK=_________________________��
��Na2SO4��Ca(OH)2��H2O��Ԫ��ϵ������������ij���������ʣ�����pH=12.3 [��c(OH��)=0.02mol/L]����ʹ��Ӧ�ڳ����������С���Ӧ����ˣ�������Һ��ͨ��CO2����һ�������õ�Na2CO3��
��2����Na2SO4��Ca(OH)2��H2O��Ԫ��ϵ�в�ֱ��ͨ��CO2����������_______________________________________________________________��
��3�����ӵ����������������������д�����㣩��_____________��______________��
��4����ƽ���ƶ�ԭ�����������������ʵ����ɣ�____________________________________����HA��ʾ�����ӵ����ʣ����ܷ�Ӧ�����ӷ���ʽ��дΪ_______________________��
��5��Na2CO3��Һ�д���ˮ��ƽ�⣺CO32����H2O![]() HCO3����OH��������˵���������_________��
HCO3����OH��������˵���������_________��
a����ˮϡ�ͣ���Һ���������ӵ�Ũ�ȶ���С
b��ͨ��CO2����ҺpH��С
c������NaOH���壬![]() ��С
��С
d��ϡ����Һ��ƽ�ⳣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com