
【题目】在一个容积固定为2L的密闭容器中,发生反应:aA(g)+bB(g)pC(g)△H=?,反应情况记录如表:
时间(min) | n(A)(mol) | n(B)(mol) | n(C)(mol) |
0 | 1 | 3 | 0 |
第2min | 0.8 | 2.6 | 0.4 |
第4min | 0.4 | 1.8 | 1.2 |
第6min | 0.4 | 1.8 | 1.2 |
第8min | 0.1 | 2.0 | 1.8 |
第9min | 0.05 | 1.9 | 0.3 |
请根据表中数据仔细分析,回答下列问题:
(1)第2min到第4min内A的平均反应速率v(A)=molL﹣1min﹣1
(2)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、6min时分别改变了某一个反应条件,则改变的条件分别可能是:①第 2min;②第 6min;
(3)反应在第4min建立平衡,此温度下该反应的化学平衡常数 K= .
(4)判断第9min时(是/否)达平衡,说明理由 .
【答案】
(1)0.1
(2)使用催化剂、升高温度;增加B的浓度
(3)2.22
(4)否;因为Qc<K
【解析】解:在前2min内,各物质的浓度的变化量之比(1﹣0.8):(3﹣2.6):(0.4﹣0)=1:2:2,则方程式为A (g)+2B(g)2C(g).
(1.)第2min到第4min内A物质的化学反应速率v(A)= ![]() =
= ![]() =0.1mol/(lmin),所以答案是:0.1;
=0.1mol/(lmin),所以答案是:0.1;
(2.)①在第0~2min内,A的物质的量减小了0.2mol,在2~4min内A的物质的量在原基础上减小了0.4mol,化学反应速率加快了,可以是使用催化剂或升高温度,所以答案是:使用催化剂、升高温度;
②第6min 到第8min,作为反应物,浓度应该是减小的趋势,但是B的物质的量从1.8mol增加到了2.0mol,而A在减小,C在增大,所以可知一定是加入了B物质
所以答案是:增加B的浓度;
(3.)反应在第4min建立平衡,c(A)= ![]() =0.2mol/L,c(B)=
=0.2mol/L,c(B)= ![]() =0.9mol/L,c(C)=
=0.9mol/L,c(C)= ![]() =0.6mol/L,则K=
=0.6mol/L,则K= ![]() =
= ![]() =2.22;
=2.22;
所以答案是:2.22;
(4.)Qc= ![]() =
= 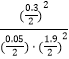 =0.997<K=2.22,则反应未达到平衡状态;所以答案是:否,因为Qc<K.
=0.997<K=2.22,则反应未达到平衡状态;所以答案是:否,因为Qc<K.
【考点精析】根据题目的已知条件,利用化学平衡状态本质及特征和化学平衡的计算的相关知识可以得到问题的答案,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】通过对酸、碱、盐知识的学习,我们已经知道固体氢氧化钠可以作为某些气体的干燥剂,下列潮湿的气体不能用固体氢氧化钠干燥的 ( )
A.H2B.CO2C.COD.O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“西气东输”的气体是指天然气,主要成分是甲烷.工业上用碳与水在高温下反应制得水煤气.水煤气的主要成分是CO和H2 , 两者体积比约为1:1.1mol CO气体完全燃烧生成CO2气体放出283kJ热量,1molH2完全燃烧生成气态水放出242kJ热量;1molCH4气体完全燃烧生成CO2气体和气态水放出802kJ热量.
(1)写出H2完全燃烧生成气态水的热化学反应方程式:;
(2)忽略水煤气中其它成分,相同状况下若产生相等的热量,则所需水煤气体积是甲烷体积的倍,水煤气放出CO2的体积是甲烷放出CO2的体积的倍.
(3)以天然气代替水煤气作民用燃料,突出的优点是和 . (任写2点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如图1所示(部分产物已略去): 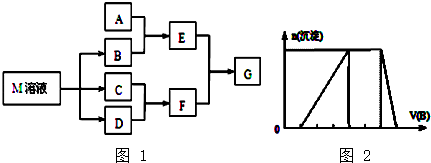
(1)写出用惰性电极电解M溶液的离子方程式 .
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是 .
(3)若A是一种常见金属单质,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是 .
(4)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚溶液后显紫色,则由A转化成E的离子方程式 .
(5)若A是一种化肥.实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是 .
(6)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32﹣、SO42﹣中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图2所示,由此可知,该溶液中除H+和Al3+外肯定还含有离子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,能溶于水,可由乳酸与FeCO3反应制得.
Ⅰ.制备碳酸亚铁:装置如图所示.
(1)装置B中可观察到的现象是铁粉逐渐溶解,
(2)将B中生成的FeCl2溶液压入装置C的操作是
(3)Ⅱ.制备乳酸亚铁:将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸.
加入少量铁粉的作用是
(4)从所得溶液中获得乳酸亚铁晶体所需的实验操作是、、洗涤、干燥.
(5)设计实验证明乳酸亚铁中含 Fe2+: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,下列物质间的转化能一步实现的是 ( )
①Fe→Fe3O4 ②S→SO3 ③CuCl2→Cu ④CH4→CO2
A.①②③B.①②④C.①③④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的分子式为C10H14,能使高锰酸钾酸性溶液褪色,不能使溴水褪色,分子结构中含两个相同的烷基,则此烃可能的结构有
A.2种B.3种C.4种D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.铁和稀硫酸反应:2Fe+6H+![]() 2Fe3++3H2↑
2Fe3++3H2↑
B.氯化铝溶液中加入过量氨水制取氢氧化铝:Al3++3NH3·H2O![]() Al(OH)3↓+3
Al(OH)3↓+3![]()
C.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu![]() Fe2++Cu2+
Fe2++Cu2+
D.氢氧化钠溶液中通入少量二氧化硫气体 :SO2+OH![]()
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com