
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:


| ||
| ||
| 168Q |
| m |
| 168Q |
| m |
查看答案和解析>>
科目:高中化学 来源:2015届江西省景德镇市高二上学期期中质量检测理科化学试卷(解析版) 题型:填空题
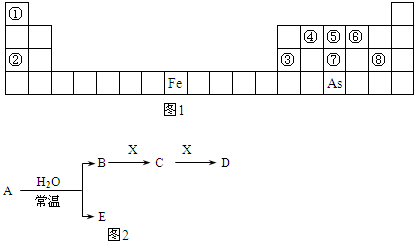
(11分)(1)现有A、B、C、D、E五种原子序数递增的主族元素,A的原子核中没有中子;B、D元素处于同一周期,D的原子半径较小,B、D的质子数之和为27,质子数之差为5;C的单质跟盐酸反应,生成C3+和氢气;E和D能形成E2D型离子化合物,且E、D两元素的简单离子具有相同电子层结构。
① 写出元素符号:A ,D ,E 。
② B、C的最高价氧化物对应水化物相互反应的离子方程式为:
。
③ 写出A2D的电离方程式: , 。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。N P AS ;O S Se 分别是VA族、VIA族连续三元素。
①根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
② 元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度,请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③将SO2气体通入溴水恰好完全反应后,溶液中存在的离子浓度由大到小的顺序是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
O、S、As 三种元素比较,正确的是
A.电负性O > S > As,原子半径O < S < As
B.电负性O < S < As,原子半径O < S < As
C.电负性O < S < As,原子半径O > S > As
D.电负性O > S > As,原子半径O > S > As
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com