
 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| ① | | | | | | | | | | | | | | | | | |
| | ② | | | | | | | | | | | | ③ | | | | |
| | ④ | | | | | | | | | | | ⑤ | | | ⑥ | ⑦ | |
| | ⑧ | | | | | | ⑨ | | | ⑩ | | | | | | | |


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若XY4分子中X原子处于正四面体的中心,则XY4分子为非极性分子 |
| B.C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键 |
| C.CO2与SiO2晶体熔化时,所克服的微粒间相互作用相同 |
| D.短周期元素离子aXm+和bYn-具有相同的电子层结构,则a>b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
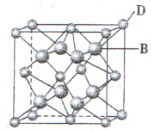
 和
和 代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。
代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
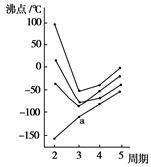
| A.H2S | B.HCl | C.PH3 | D.SiH4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.附着在试管内壁上的AgCl固体可用氨水溶解而洗去 |
| B.可用氨水鉴别AlCl3、AgNO3和CuSO4三种溶液 |
| C.向氨水中滴加CuSO4溶液至过量,先产生蓝色沉淀,然后沉淀溶解并得到深蓝色溶液 |
| D.加热碘单质,产生紫色碘蒸气,这个过程只克服范德华作用力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com