
| A. | ①②⑥ | B. | ①②⑤ | C. | ③④ | D. | ①⑥ |
分析 在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水;
在水溶液里和熔融状态下都不能导电的化合物是非电解质,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等).
解答 解:①氢氧化钠在水溶液里或熔融状态下能导电的化合物是电解质;
②氯化钠溶液是混合物,不是电解质,也不是非电解质;
③铜是单质,不是电解质,也不是非电解质;
④蔗糖在水溶液里和熔融状态下都不能导电的化合物是非电解质;
⑤二氧化碳是化合物,本身不能电离产生自由移动的离子,是非电解质;
⑥硫酸钡熔融状态下能导电的化合物是电解质;
故选:D.
点评 本题考查了电解质、非电解质判断,明确电解质、非电解质概念是解题关键,注意电解质、非电解质都是化合物,单质和混合物既不是电解质,也不是非电解质.


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:填空题
 用图示的装置进行电解,通电一段时间后,发现Pt电极上有气泡冒出.
用图示的装置进行电解,通电一段时间后,发现Pt电极上有气泡冒出.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=0.40/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| C. | 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol | |
| D. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| $\frac{P}{{P}_{0}}$ | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
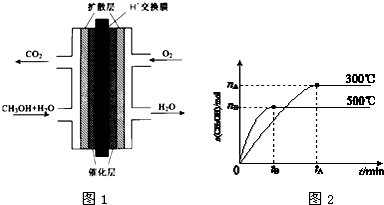
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| B. | 向沸水中滴加饱和FeCl3溶液,持续加热最终能得到Fe(OH)3胶体 | |
| C. | “忽闻海上有仙山,山在虚无缥缈间”描述了一种与胶体有关的自然现象 | |
| D. | 水泥厂、冶金厂常用静电除尘法除去烟尘,利用了胶体带电的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧化合物 | B. | 钠盐 | C. | 电解质 | D. | 碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱--①④ | B. | 电解质--③④⑤ | C. | 混合物--②③ | D. | 盐--②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟稀硫酸反应 Fe+2H+═Fe2++H2↑ | |
| B. | 碳酸氢钙溶液跟盐酸反应 Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | 醋酸跟氢氧化钾溶液反应 CH3COOH+OH-═CH3COO-+H2O | |
| D. | 碳酸镁跟硫酸反应 MgCO3+2H+═Mg2++H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com