
分析 Q蒸气对氢气的相对密度是29,相同条件下的气体密度之比等于其相对分子质量之比,所以Q的相对分子质量为58;5.8gQ的物质的量是0.1mol,13.2g二氧化碳为0.3mol,0.3molCO2中n(C)=0.3mol,0.3molH2O中n(H)=0.6mol,所以Q分子中含有3个C原子和6个H原子;Q能够发生酯化反应,则Q中含有O,根据Q的相对分子量确定O原子数;再结合Q分子中不含甲基,且为链状结构判断Q的结构简式,以此解答.
解答 解:Q蒸气对氢气的相对密度是29,相同条件下的气体密度之比等于其相对分子质量之比,所以Q的相对分子质量为:2×29=58,
5.8gQ的物质的量是:$\frac{5.8g}{58g/mol}$=0.1mol,
13.2g二氧化碳的物质的量为:$\frac{13.2g}{44g/mol}$=0.3mol,0.3molCO2中n(C)=0.3mol,
0.3molH2O中n(H)=0.6mol,
所以Q分子中含有3个C原子和6个H原子,由于能够发生酯化反应,其分子中一定含有O元素,含有氧原子的数目为:$\frac{58-12×3-1×6}{16}$=1,
则Q的分子式为:C3H6O,
Q分子中不含甲基,且为链状结构、能够发生酯化反应,
则Q分子中含有碳碳双键和羟基,结合C=C-OH不稳定可知Q的结构简式为:CH2=CH-CH2-OH,
答:Q的结构简式为CH2=CH-CH2-OH.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,注意掌握质量守恒定律在确定有机物分子式中的应用方法,试题侧重考查学生的分析、理解能力及化学计算能力.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | 负极发生的反应为:Fe-2e-═Fe2+ | |
| B. | 正极发生的反应为:2H2O+O2+2e-═4OH- | |
| C. | 钢和铁都是铁合金,所以它们的组成基本相同 | |
| D. | 插在水中的钢柱在水下部分比在空气与水交界处更容易腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
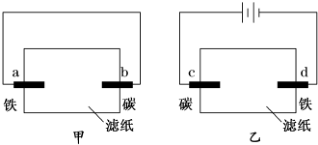
| A. | 滤纸上的阴离子都向碳棒迁移 | B. | a、d两极的电极反应式相同 | ||
| C. | b、d两极附近的溶液都变红 | D. | c、d两极均有少量气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
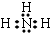 ,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子含有共价键、配位键(填化学键的种类),该离子氯化物的水溶液呈酸性,用离子方程式表示为NH4++H2O?NH3•H2O+H+.
,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子含有共价键、配位键(填化学键的种类),该离子氯化物的水溶液呈酸性,用离子方程式表示为NH4++H2O?NH3•H2O+H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸馏水中滴加稀H2SO4,c(H+)和KW都增大 | |
| B. | 在Na2S稀溶液中,c(OH-)+c(HS-)+2c(S2-)═c(H+)+c(Na+) | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 等体积0.2mol/LHCl溶液与0.05mol/LBa(OH)2溶液混合后,溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | 只有④ | D. | 全部不是 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ④②⑤①③ | D. | ⑤②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

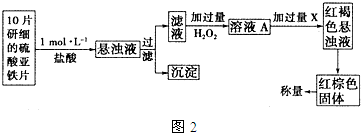
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNa2O2与水反应转移电子数为0.1 NA | |
| B. | 标准状况下,11.2L HF含有的分子数为0.5 NA | |
| C. | 1mol S在足量O2中燃烧,转移的电子数为6 NA | |
| D. | 7.8g Na2O2固体中所含阴离子数为2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com