
(1)A、B、C、D、E、F是元素周期表前四周期的元素,它们在元素周期表中的位置如图所示:
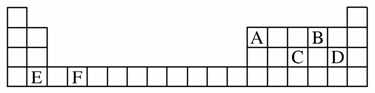
①写出F的基态原子的核外电子排布式:___________________________________________
________________________________________。
②C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是____________________。
(2)A、B、C 3种元素中,A的第一电离能最小,C的电负性最大,3种元素的失电子能力由强到弱的顺序为
___________________________________________。
(3)D、E两种元素形成的化合物化学式为____________________。
解析 (1)根据题给周期表可知,A为硼元素,B为氧元素,C为磷元素,D为氯元素,E为钙元素,F为钛元素。磷原子的最外层电子排布式为3s23p3,处于半充满,它比相邻两元素的第一电离能都高。
(2)原子的电离能越小,失电子能力越强;原子的电负性越大,得电子能力越强,失电子能力越弱。硼的第一电离能最小,因此硼失电子能力最强;氧的电负性最大,因此氧的失电子能力最弱,其顺序为A>C>B(或B>P>O)。
(3)E与D形成的化合物为CaCl2。
答案 (1)①1s22s22p63s23p63d24s2 ②磷原子的最外层电子排布式3s23p3,它处于半充满稳定状态
(2)A>C>B (填B>P>O也可)
(3)CaCl2


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
某学生称取9 g直链淀粉溶于水,测定淀粉水解的百分率,其程序如下:
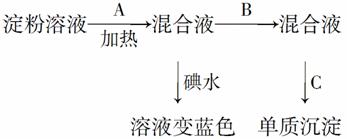
(1)填写各步所加试剂名称:A.________;B________;C________。
(2)只加A溶液而不加B溶液是否可以?________。
理由是________________________________________________________________________。
(3)当析出2.16 g金属单质时,淀粉的水解率为________
(已知1 mol醛基发生银镜反应时生成2 mol Ag)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.SiH4比CH4稳定
B.O2-半径比F-的小
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
某氖原子的质量为a g,一个12C原子质量为b g,NA表示阿伏加德罗常数,则下列说法中正确的是( )
A.氖元素的相对原子质量一定是12a/b
B.W g该氖原子的物质的量一定是W/(aNA)mol
C.该氖原子的摩尔质量是aNA g
D.W g该氖原子所含的质子数是10 W/(aNA)
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( )
A.原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、W形成的化合物不能发生反应
C.X的最高价氧化物对应的水化物的酸性比W的弱
D.Y的气态简单氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对四个量子数的说法正确的是( )
A.自旋磁量子数ms用来标记电子的自旋运动状态
B.磁量子数m=0的轨道都是球形的轨道
C.角量子数l的可能取值是从0到n-1的整数
D.多电子原子中,电子的能量只取决于主量子数n
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2气体在一定条件下可与金属镁反应,干冰在一定条件下也可以形成CO2气体,这两个变化过程中需要克服的作用力分别是( )
A.化学键,化学键
B.化学键,分子间作用力
C.分子间作用力,化学键
D.分子间作用力,分子间作用力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com