
 工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.
工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.分析 (1)根据盖斯定律,由已知热化学方程式乘以合适的系数进行适当的加减,反应热也乘以相应的系数进行相应的加减;
(2)燃料电池的正极是燃料空气中的氧气得电子发生还原反应,即O2 +4e-+2H2O=4OH-;
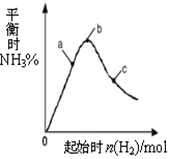
(3)①温度对化学平衡移动的影响,升高温度化学平衡向逆反应移动氨气的平衡百分含量减少;
②化学平衡转化率的考查,对多种物质参加反应,改变其中一种物质,对另一物质转化率的影响;
(4)由反应转化关系知,反应过程中钠元素守恒,设NaNO2和NaNO3的物质的量分别为4a mol和a mol,
则4a+a=50mL×10-3mL•L-1×1.0 mol•L-1×2,
解得:a=0.02 mol,
则2NO2+Na2CO3=NaNO2+NaNO3+CO2,
0.04mol 0.02mol 0.02mol
NO+NO2+Na2CO3=2NaNO2+CO2
0.03mol 0.03mol 0.06mol
于是,推出NO、NO2的物质的量分别为:0.03 mol、0.07 mol,由此分析解答.
解答 解:(1)已知:①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ•mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
③NO2(g)?$\frac{1}{2}$N2O4(g)△H=-26.35kJ•mol-1
根据盖斯定律,②×2-①-③×2得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),
故△H=2×(-534.0kJ•mol-1)-67.7kJ•mol-1-2×(-26.35kJ•mol-1)=-1083kJ•mol-1,
故热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083kJ•mol-1,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083kJ•mol-1;
(2)燃料电池的正极是燃料空气中的氧气得电子发生还原反应,1mol氧气得到4mol电子,结合2mol电子生成4molOH-,故答案为:O2 +4e-+2H2O=4OH-;
(3)①正反应是放热反应,则升高温度,平衡向逆反应方向移动,所以当温度升高时氨气的含量降低,故图象为 ,故答案为:
,故答案为: .
.
②在可逆反应A+B?C中增加一种反应物A的量,等于提高另一种反应物B的转化率,而A本身的转化率反而降低,所以氢气的量越小,H2的转化率最高,故答案为:a;
(4)由反应转化关系知,反应过程中钠元素守恒,设NaNO2和NaNO3的物质的量分别为4a mol和a mol,
则4a+a=50mL×10-3mL•L-1×1.0 mol•L-1×2,
解得:a=0.02 mol,
则2NO2+Na2CO3=NaNO2+NaNO3+CO2,
0.04mol 0.02mol 0.02mol
NO+NO2+Na2CO3=2NaNO2+CO2
0.03mol 0.03mol 0.06mol
于是,推出NO、NO2的物质的量分别为:0.03 mol、0.07 mol,
即:NO所占的体积分数为$\frac{0.03}{0.1}$×100%=30%.
答:NO的体积分数为30%.
点评 本题考查利用盖斯定律进行反应热计算、燃料电池电极反应方程式的书写,以及化学平衡原理的考查,也体现了利用所学课本知识能够学以致用,该题基础性强,难度中等,注意电极反应式的书写,为易错点、难点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
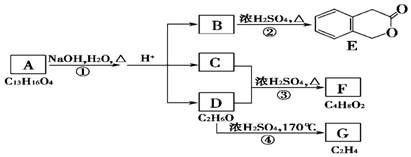
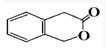 +H2O(有机物须用结构简式表示)
+H2O(有机物须用结构简式表示)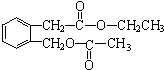 ;反应④的反应类型是消去反应.
;反应④的反应类型是消去反应. .
.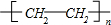 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .预测该芳香烃能(填“能”或“不能”)发生该类反应.
.预测该芳香烃能(填“能”或“不能”)发生该类反应.
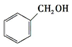 c.
c.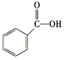
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和H2在一定条件下合成氨 | |
| B. | 加热NH4Cl使其分解,可以同时获得NH3和HCl | |
| C. | 加热NH4Cl和Ca(OH)2的固体混合物,获得NH3 | |
| D. | 加热浓氨水,促使其分解制得NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com