
分析 烃分子中只含有C、H元素,根据C的质量分数计算出H的质量分数,然后根据n=$\frac{m}{M}$计算出该烃分子中C、H的物质的量之比,从而可知该烃的通式;然后写出含有4个碳原子的该烃的分子式.
解答 解:某烃含碳的质量分数为85.7%,则含H的质量分数为:1-85.7%=14.3%,该烃分子中含有C、H的物质的量之比=$\frac{85.7%}{12}$:$\frac{14.3%}{1}$=1:2,所以该烃的通式为CnH2n;若该烃中碳原子数为4,该烃的分子式为C4H8,
答:该烃的通式为CnH2n,若该烃中碳原子数为4,该烃的分子式为C4H8.
点评 本题考查了有机物分子式确定的计算,题目难度不大,明确常见有机物组成、通式为解答关键,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
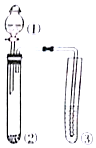 利用如图所示装置进行实验,仪器①②③中装下列试剂,③中现象描述正确的是( )
利用如图所示装置进行实验,仪器①②③中装下列试剂,③中现象描述正确的是( )| 选项 | ① | ② | ③ | 试管③中现象 |
| A | 浓盐酸 | Na2SO3 | Ba(NO3)2溶液 | 无现象 |
| B | 稀盐酸 | 大理石 | 苯酚钠溶液 | 产生白色沉淀 |
| C | 稀盐酸 | 大理石 | CaCl2溶液 | 产生白色沉淀 |
| D | 浓硫酸 | 铜片 | KI-淀粉溶液 | 溶液变蓝 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L乙烯含有的共用电子对数为5NA | |
| B. | 1 mol NaHSO4中的阳离子数为2NA | |
| C. | 通常状况下,1 mol NO和0.5 molO2 在密闭容器中混合,生成NO2分子数为NA | |
| D. | 制取漂白粉时,标准状况下22.4 LCl2 参加反应,转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
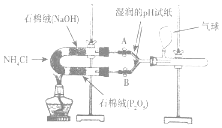 某实验小组利用如图装置验证NH4 C l受热分解时的分解产物为氨气和氯化氢.
某实验小组利用如图装置验证NH4 C l受热分解时的分解产物为氨气和氯化氢. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  装置用于蒸馏石油 | |
| B. |  装置可用来分离乙醇和乙酸 | |
| C. |  装置可用于比较碳酸、苯酚酸性的强弱 | |
| D. |  装置可用于证明溴乙烷与NaOH乙醇溶液共热生成乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:71 | B. | 71:2 | C. | 1:8 | D. | 8:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用胶头滴管向试管中滴加液体时,滴管尖端与试管内壁 | |
| B. | 过滤操作中,玻璃棒与三层滤纸 | |
| C. | 过滤操作中,漏斗下端管口与烧杯内壁 | |
| D. | 分液操作中,分液漏斗下端管口与烧杯内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
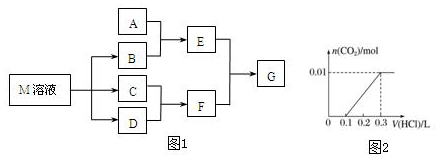
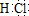
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com