
钛(Ti)因为具有神奇的性能越来越引起人们的关注,是航空、军工、电力等方面的必需材料,被誉为“空间金属”和“深海金属”。
(1)钛和钛的合金具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,钛合金与人体有很好的“相容性”。根据它们的主要性能,下列用途不切合实际的是________。
A.用来做保险丝 B.用于制造航天飞机
C.用来制造人造骨 D.用于制造船舶
(2)常温下钛不和非金属、强酸反应。红热时,却可与常见的非金属单质反应。地壳中含钛矿石之一称金红石(TiO2),目前大规模生产钛的方法是:
第一步:金红石、炭粉混合,在高温条件下通入氯气制得TiCl4和一种可燃性气体。该反应的化学方程式:______________________,该反应的还原剂是 ________________________________________________________________________。
第二步:在氩气的气氛中,用过量镁在加热条件下与TiCl4反应制得金属钛。
简述由上述所得产物中获取金属钛的步骤____________________。
(1)A
(2)TiO2+2C+2Cl2 TiCl4+2CO 碳
TiCl4+2CO 碳
加入足量盐酸,除去过量镁、MgCl2,过滤,洗涤
【解析】
试题分析:(1)物质的性质决定其用途,应结合题干所给的有关性质的信息来分析。由题干知钛和钛合金的熔点高,不能用来做保险丝;其密度小、熔点高,可塑性好,可用于制造飞机及船舶,与人体有很好的“相容性”可制造人造骨。
(2)第一步得到的可燃性气体应是CO,结合原子守恒及电子转移守恒,化学方程式应为TiO2+2C+2Cl2 TiCl4+2CO,该反应中,碳元素化合价升高,C作还原剂;第二步应为镁置换钛的反应,化学方程式为TiCl4+2Mg
TiCl4+2CO,该反应中,碳元素化合价升高,C作还原剂;第二步应为镁置换钛的反应,化学方程式为TiCl4+2Mg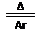 Ti+2MgCl2,所得产物含杂质镁(镁过量)、MgCl2,利用钛不与强酸反应,应加足量盐酸除去过量杂质镁、MgCl2,过滤即得钛。
Ti+2MgCl2,所得产物含杂质镁(镁过量)、MgCl2,利用钛不与强酸反应,应加足量盐酸除去过量杂质镁、MgCl2,过滤即得钛。
考点:考查合金的应用、金属的冶炼、氧化还原反应的有关判断以及方程式的书写
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查,试题基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范的答题能力。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
第一步:金红石、炭粉混合,在高温条件下通入Cl2制得TiCl4和一种可燃性气体。该反应的化学方程式为___________________________________________________________________,该反应的还原剂是__________________________。
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
写出此反应的化学方程式:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com