
| A. | 容器里气体的密度为40 g/L | |
| B. | SO3的分解率为30% | |
| C. | 在这10 min内的平均速率为v(O2)=0.05 mol•L-1•min-1 | |
| D. | 化学反应速率:v(Ag2SO4)=v(SO3) |
分析 已知①Ag2SO4(s)?Ag2O(s)+SO3(g),②2SO3(g)?2SO2(g)+O2(g),经10分钟反应达到平衡,此时c(SO3)=0.4mol/L,c(O2)=0.05mol/L,由反应②可知消耗SO30.1mol/L,生成c (SO2)=0.1mol/L,可知反应①共生成SO3的浓度为0.4mol/L+0.1mol/L=0.5mol/L,以此解答该题.
解答 解:已知①Ag2SO4(s)?Ag2O(s)+SO3(g),②2SO3(g)?2SO2(g)+O2(g),经10分钟反应达到平衡,此时c(SO3)=0.4mol/L,c(O2)=0.05mol/L,由反应②可知消耗SO30.1mol/L,生成c (SO2)=0.1mol/L,可知反应①共生成SO3的浓度为0.4mol/L+0.1mol/L=0.5mol/L,
A.平衡时c (SO2)=0.1mol/L,c (O2)=0.05mol/L,c(SO3)=0.4mol/L,设容器体积为1L,
则m(SO2)=0.1mol/L×1L×64g/mol=6.4g,m(O2)=0.05mol/L×1L×32g/mol=1.6g,m(SO3)=0.4mol/L×1L×80g/mol=32g,则容器内气体密度=$\frac{6.4g+1.6g+32g}{1L}$=40g/L,故A正确;
B.SO3的分解率=$\frac{0.1mol/L}{0.5mol/L}×100%$=20%,故B错误;
C.在这10 min内的平均速率=$\frac{0.1mol/L}{10min}$=0.01 mol•L-1•min-1,故C错误;
D.因为纯固体不可以用来表示反应速率,所以υ(Ag2SO4)表达错误,故D错误;
故选A.
点评 本题考查化学平衡计算,为高频考点,侧重考查学生分析计算能力,明确三氧化硫在①②方程式中发生的反应是解本题关键,易错选项是D,注意化学平衡常数表达式和含义,题目难度不大.


科目:高中化学 来源: 题型:实验题
 硫酸锰铵[(NH4)2SO4•MnSO4•nH2O]是浅粉色晶体,易溶于水,在农业上用作微量元素肥料.实验室由MnO2制备硫酸锰铵的实验步骤如下:
硫酸锰铵[(NH4)2SO4•MnSO4•nH2O]是浅粉色晶体,易溶于水,在农业上用作微量元素肥料.实验室由MnO2制备硫酸锰铵的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度能加快反应速率的主要原因,是增加了反应物分子中活化分子的百分数 | |
| B. | 正反应是吸热反应,达到平衡时,升高温度,v正增大,v逆减小,所以平衡向正反应方向移动 | |
| C. | 一定条件下增大反应物的量,一定会加快反应速率 | |
| D. | 对于任何一个化学反应,用其中任何一种反应物浓度的减小来表示化学反应速率,都是相同的数值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol羟基与1 mol氢氧根离子所含的电子数均为9NA | |
| B. | 常温下,44 g N2O和CO2组成的混合气体,所含原子数为3NA | |
| C. | 0.1 mol/L的NaClO溶液,含有的阴离子数为0.1NA | |
| D. | 常温下,将 1 mol Fe投入过量浓硝酸中,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
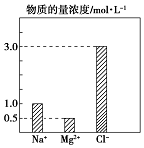 某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42-、CO32-.为了进一步确认,对该溶液进行实验检测:
某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42-、CO32-.为了进一步确认,对该溶液进行实验检测:| 实验操作与现象 | 实验结论 | 判断理由 | |
| 步骤一 | 仔细观察坐标图 | 肯定无 CO32- | 肯定无该离子的理由碳酸根离子和镁离子之间会反应 |
| 步骤二 | 该溶液呈无色、透明、均一状态 | 肯定无 Fe3+ | 肯定无该离子的理由该离子为黄色 |
| 步骤三 | 加入足量BaCl2溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失 | 肯定有SO42-、H+;肯定无Ba2+ | 肯定有H+的理由电荷守恒 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
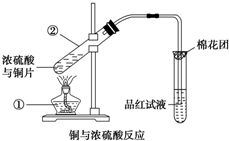 如图是铜与浓硫酸反应的实验装置图,请回答下列问题.
如图是铜与浓硫酸反应的实验装置图,请回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com