
将Ca(OH)2加入蒸馏水中,一段时间后达到沉淀溶解平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq)。下列说法中正确的是( )
A.恒温下向溶液中加CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.恒温下向溶液中加CaO后,溶液中的n(OH-)减小
D.向溶液中加入少量的NaOH固体,Ca(OH)2固体的质量不变
科目:高中化学 来源: 题型:
把稀硫酸倒在亚硫酸钠粉末上,能使反应的最初速率加快的是( )
①增大亚硫酸钠粉末的量 ②硫酸浓度增大一倍,用量减少到原来的1/2 ③硫酸浓度不变,用量增大一倍 ④使反应在较高温度进行
A.①② B.②④ C.①③ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.SO2和Cl2都能使品红溶液褪色,且加热后均恢复原色
B.SiO2是酸性氧化物,能与NaOH溶液反应
C.紫色石蕊试液滴入SO2水溶液中,先变红后褪色
D.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,则该溶液中一定含有SO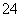
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列几种物质:①NH3·H2O ②NH4Cl
③(NH4)2SO4 ④NH4HSO4 ⑤NH4HCO3
⑥Na2CO3 ⑦NaHCO3 ⑧NaOH
按要求回答问题:
(1)能促进水的电离且溶液呈酸性的是________。
(2)同浓度的①~④的溶液中c(NH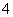 )由大到小的顺序是____________________。
)由大到小的顺序是____________________。
(3)常温下,同浓度⑤~⑧溶液,pH由小到大的顺序是________________。
(4)NaHCO3溶液显碱性的原因是___________________________________________________。
(5)NaHCO3溶液的电荷守恒式:____________________________________________________;
NaHCO3溶液的物料守恒式:______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01 mol,下列叙述错误的是( )
A.与NaOH完全中和时,醋酸所消耗的NaOH多
B.分别与足量CaCO3反应时,放出的CO2一样多
C.两种溶液的pH相等
D.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱工业中电解饱和食盐水时,用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)=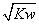 mol·L-1
mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 mol·L-1 的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )
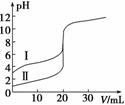
A.Ⅱ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C.V(NaOH) =20.00 mL时,两份溶液中c(Cl-)=c(CH3COO-)
D.V(NaOH) =10.00 mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
常温时,将CH3COOH溶液和NaOH溶液等体积混合后,溶液呈中性,则下列说法中正确的是(双选)( )
A.混合前:pH(CH3COOH)+pH(NaOH)=14
B.混合后:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.混合前:c(CH3COOH)>c(NaOH)
D.混合后:c(Na+)>c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com