
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
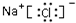
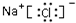
时间(h) 熔出率 温度 |
1.5 | 2.5 | 3.0 | 3.5 | 4.0 | 5.0 |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 | 0.183 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 | 0.687 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 | 0.690 |
| 950℃ | 0.669 | 0.714 | 0.710 | 0.714 | 0.714 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:
时间(h) 溶出率 温度 |
1.5 | 2.5 | 3.0 | 3.5 | 4.0 | 5.0 |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 | 0.183 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 | 0.687 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 | 0.690 |
| 950℃ | 0.669 | 0.714 | 0.710 | 0.714 | 0.714 | -- |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市东城区高三第二学期综合练习(二)化学试卷(解析版) 题型:填空题
一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s) KCl(l)+NaAlSi3O8(s)。
KCl(l)+NaAlSi3O8(s)。
(1)氯化钠的电子式是 。
(2)上述反应涉及的元素中,原子半径最大的是 。
(3)上述反应涉及的位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最价氧化物的水化物均能发生反应,该元素是 。
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量的百分率)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
|
时间(h) 熔出率 温度 |
1.5 |
2.5 |
3.0 |
3.5 |
4.0 |
5.0 |
|
800℃ |
0.054 |
0.091 |
0.127 |
0.149 |
0.165 |
0.183 |
|
830℃ |
0.481 |
0.575 |
0.626 |
0.669 |
0.685 |
0.687 |
|
860℃ |
0.515 |
0.624 |
0.671 |
0.690 |
0.689 |
0.690 |
|
950℃ |
0.669 |
0.714 |
0.710 |
0.714 |
0.714 |
―― |
①分析数据可以得出,氯化钠熔浸钾长石是 (填“放热”或“吸热”)反应。
②950℃时,欲提高熔出钾的速率可以采取的措施是 (填序号)。
a.充分搅拌
b.延长反应时间
c.增大反应体系的压强
d.将钾长石粉粹成更小的颗粒
(5)该方法制得KCl提纯后可用来冶炼金属钾。反应Na(l)+KCl(l) NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,用平衡原理解释该方法可行的原因是 。
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,用平衡原理解释该方法可行的原因是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省杭州市高三上学期期中考试化学试卷 题型:选择题
工业上冶炼金属,常用的方法有四种:Ⅰ、热分解法,Ⅱ、热还原法,Ⅲ、电解法,Ⅳ、湿法冶金。下表中金属与常用冶炼方法相符的是:
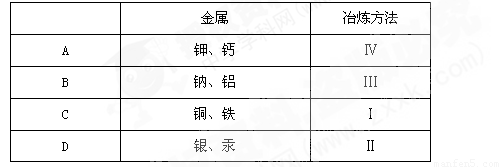
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间(h) 熔出率 温度 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 | 5.0 |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 | 0.183 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 | 0.687 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 | 0.690 |
| 950℃ | 0.669 | 0.714 | 0.710 | 0.714 | 0.714 | -- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com