
| A.醋酸钠溶液显碱性 |
B.10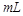  =2的醋酸溶液加水稀释到100 =2的醋酸溶液加水稀释到100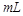   3 3 |
C.中和10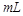 0.1 0.1 醋酸溶液,需要消耗0.1 醋酸溶液,需要消耗0.1 氢氧化钠溶液10 氢氧化钠溶液10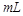 |
| D.0.1 mol·L-1的醋酸溶液中,氢离子浓度约为0.001 mol·L-1 |
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
| B.因为CH3COOH是弱电解质,HCl是强电解质,所以中和等体积等物质的量浓度的醋酸和盐酸时,中和醋酸消耗的NaOH比盐酸消耗的NaOH用量少 |
| C.物质的量浓度相同的磷酸钠溶液和磷酸溶液中PO43-的物质的量浓度相同 |
| D.足量Zn分别和等体积、等物质的量浓度的盐酸和醋酸反应时,产生H2的量相同,放出H2的速率不等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加水稀释后,溶液中c(H+)和c(OH-)都减少 |
| B.温度升高后,溶液的pH增大 |
| C.加入少量Na2CO3固体,醋酸电离平衡向左移动 |
| D.加入少量冰醋酸后,溶液的c(H+)增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HCN易溶于水 |
| B.1mol/L氢氰酸溶液的pH约为3 |
| C.10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应 |
| D.HCN溶液的导电性比盐酸溶液的弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a2 = a3<a4<a1 | B.a3 = a2<a1<a4 |
| C.a2<a3<a1<a4 | D.a1<a2<a3<a4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com