
【题目】将标准状况下6.72LHCl溶于水配成100mL溶液,取该溶液40mL与一定量的碳酸钙恰好完全反应。计算:
(1)此盐酸的物质的量浓度。(写出计算过程,下同)_____________________
(2)参与反应的碳酸钙的质量是多少?_________________
【答案】n(HCl)=![]() ,c(HCl)=
,c(HCl)=![]() M(CaCO3)=100g·mol-1,n(HCl)=3mol·L-1×0.04L=0.12mol,由化学方程式CaCO3+2HCl=CaCl2+CO2↑+H2O知,n(CaCO3)= n(HCl)×
M(CaCO3)=100g·mol-1,n(HCl)=3mol·L-1×0.04L=0.12mol,由化学方程式CaCO3+2HCl=CaCl2+CO2↑+H2O知,n(CaCO3)= n(HCl)×![]() = 0.12mol×
= 0.12mol×![]() =0.06mol ,m(CaCO3)=100g·mol-1×0.06mol=6g(计算过程合理即可)。
=0.06mol ,m(CaCO3)=100g·mol-1×0.06mol=6g(计算过程合理即可)。
【解析】
(1)据![]() 进行计算;
进行计算;
(2)CaCO3+2HCl=CaCl2+CO2↑+H2O依据此方程式进行计算;
(1) ![]() ,n(HCl)=
,n(HCl)=![]() ,则
,则 ![]() ;
;
答案为:![]() ;
;
(2)CaCO3+2HCl=CaCl2+CO2↑+H2O,依据此方程式找出关系式列式计算如下: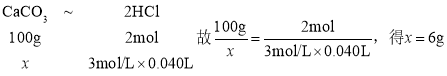 ;
;
答案为:6g。


科目:高中化学 来源: 题型:
【题目】某温度下,在 2L的密闭容器中,加入1molX(g)和 2molY(g)发生反应:X(g)+mY(g)3Z(g) ΔH=-Q kJ·molˉ1(Q>0),10min后该反应达到平衡时,X、Y的物质的量分别为0.9mol、1.8mol。下列叙述不正确的是
A.m=2
B.在0~10min内,X的反应速率为 0.005mol·Lˉ1·minˉ1
C.10min后,X的消耗速率等于Y的生成速率
D.在0~10min内,X和 Y反应放出的热量为 0.1Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、F是家庭中常见的有机物,F常用于食品包装,E是石油化工发展水平的标志。根据下面转化关系回答问题。

(1)分别写出A和E中官能团的名称:A中_________;E中_________;
(2)操作⑥的名称为________________。
(3)写出反应类型:④_________;
(4)请写出下列反应的化学方程式:
①写出A和B在浓硫酸中加热反应的方程式_________________;
②B在金属铜存在下在空气中加热反应________________;
(5)F是一种常见的高分子材料,它给我们带来了巨大的方便。然而,这种材料造成的当今的某一环境问题是__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL ![]() 溶液中滴加
溶液中滴加![]() 的
的![]() 溶液,滴加过程中,溶液中
溶液,滴加过程中,溶液中![]() 与
与![]() 溶液体积(V)的关系如图所示,下列说法正确的是( )已知:
溶液体积(V)的关系如图所示,下列说法正确的是( )已知: ![]() 。
。
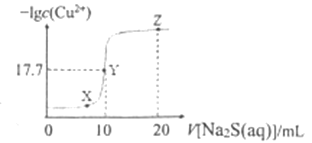
A. 该温度下 ![]()
B. X、Y、Z三点中,Y点水的电离程度最小
C. ![]() 溶液中:
溶液中:![]()
D. 向100 mL ![]() 浓度均为
浓度均为![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 的
的![]() 溶液,
溶液,![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是应用广泛的化工原料和前景乐观的无色液体燃料。请按要求回答下列问题。
(1)已知25℃、101 kpa时一些物质的燃烧热如下表:
物质 | CH3OH(l) | CO(g) | H2(g) |
燃烧热/(kJ/mol) | 726.8 | 283.0 | 285.8 |
写出由CO和H2反应生成CH3OH(l)的热化学方程式: _________________________。
(2)一定温度下,在容积为2L的恒容密闭容器中进行反应:CO(g)+2H2(g)=CH3OH(g),其相关数据如图所示。

①从反应开始至5min时,用CH3OH表示的反应平均速度为____________。
②图中反应达平衡时,K=_______(mol/L)-2;CO的平衡转化率为________________。
(3)人们利用甲醇制得能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,该装置工作时,a极反应式为____________________。

若用该电池及惰性电极电解2L饱和和食盐水产生224mL(标准误差2)Cl2时(假设全部句逸出并收集,忽略溶液体积的变化),常温下所得溶液的pH为________。
(4)甲醇在一定条件下可转化为甲酸。常温下,向0.1mol/L HCOOH溶液中滴加0.1mol/LNaOH溶液至pH=7[已知,K(HCOOH)=1.8×10-4]。此时混合游学中两溶质的物质的量之比n(HCOOH):n(HCOONa)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气电池是一种用锂作负极,以空气中的氧气作为正极反应物的电池。其工作原理如图,下列说法中错误的是( )

A. 多孔电极可以提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 正极的电极反应:![]()
C. 有机电解液可以是乙醇等无水有机物
D. 充电时专用充电电极可防止空气极腐蚀和劣化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题。
(1)配制100mL 2mol/L的NH4Cl溶液。该同学应用天平称量NH4Cl固体的质量为______g。
(2)有以下仪器:烧杯、胶头滴管、玻璃棒、量筒等玻璃仪器。
①还缺少的玻璃仪器有__________;
②使用此仪器前必须进行的一步操作是_______;
(3)该同学又用如图所示的装置收集干燥纯净的氨气并做性质实验:

①写出A处氯化铵与熟石灰反应的化学方程式:______________
②B中盛放的是__________其作用是__________
③氨水中滴加酚酞溶液变为________色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某度旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:

已知:I.铍、铝元素化学性质相似;
Ⅱ.常温下部分难溶物的溶度积常数如下表:

(1)滤液A的主要成分除NaOH外,还有_____________(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:_______________________________________________。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为_______(填字母)
a.加入过量的氨水 b.通入过量的CO2
c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质.写出反应Ⅱ中CuS发生反应的化学方程式:____________________________________________。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是___________(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出)
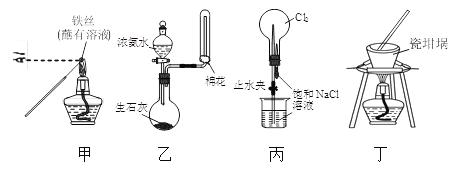
A. 用装置甲检验溶液中是否有K+
B. 用装置乙制取并收集少量NH3
C. 用装置丙进行喷泉实验
D. 用装置丁加热熔融NaOH固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com