
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定呈碱性 | |
| C. | 某无色溶液中加入BaCl2溶液,再加稀盐酸,沉淀不溶解,原溶液中一定有SO42- | |
| D. | 某无色溶液中加入酚酞试液变红,该溶液一定是碱溶液 |
分析 A.萃取剂和原溶剂不能互溶;
B.能使湿润的红色石蕊试纸变蓝色的气体为碱性气体;
C.能和氯化钡溶液反应生成不溶于稀盐酸的离子有SO42-或Ag+;
D.能使酚酞试液变红色的溶液可能是碱溶液也可能是盐溶液.
解答 解:A.萃取剂和原溶剂不能互溶,乙醇和水互溶,所以不能用乙醇作碘水的萃取剂,故A错误;
B.能使湿润的红色石蕊试纸变蓝色的气体为碱性气体,某气体能使湿润的红色石蕊试纸变蓝,说明该气体为碱性气体,该气体的水溶液为碱,所以一定呈碱性,故B正确;
C.能和氯化钡溶液反应生成不溶于稀盐酸的离子有SO42-或Ag+,则该溶液中不一定含有硫酸根离子,故C错误;
D.能使酚酞试液变红色的溶液可能是碱溶液也可能是盐溶液,如碳酸钠溶液等,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及萃取剂的选取、气体性质、离子检验、溶液酸碱性等知识点,明确实验原理及物质性质是解本题关键,注意:检验离子时要排除其它离子的检验方法,易错选项是C.


科目:高中化学 来源: 题型:解答题
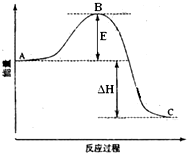 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的乙烯与乙醇充分燃烧时消耗氧气的质量相等 | |
| B. | 生活中用于制造水杯、奶瓶、食物保鲜膜等用品的聚氯乙烯是通过加聚反应得到的 | |
| C. | 分子式为C6H12的某链状有机物,6个碳原子肯定在同一平面上,则与氢气加成后产物的名称为2,3-二甲基丁烷 | |
| D. | 红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构分别如图所示: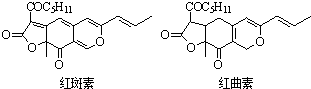 太阳能光触媒则红斑素和红曲素互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | |
| B. | 利用重结晶可对粗苯甲酸进行提纯 | |
| C. | 不能用核磁共振氢谱来鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
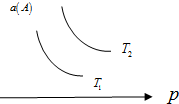 在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )
在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )| A. | a+b<c | |
| B. | 若T2>T1,则该反应在高温下易自发进行 | |
| C. | △H>0 | |
| D. | 若T2<T1,则该反应一定不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇沸点是78.5℃,将含水酒精直接加热蒸馏可制得无水酒精 | |
| B. | 除去二氧化碳气体中混有的少量氯化氢气体,可以将气体通过饱和碳酸氢钠溶液 | |
| C. | 可以用醋酸除去锅炉中的水垢(主要成分为碳酸钙) | |
| D. | 仅采用物理方法无法将晾晒海水得到的粗盐转变为精盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
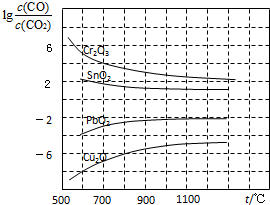 数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.
数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 降低温度,溶液中c(NH4+)增大 | |
| C. | 加入少量NaOH固体,平衡向左移动,电离平衡常数减小 | |
| D. | 加入少量0.1 mol•L-1 盐酸,溶液中c(OH-)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com