
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
(1)S C
(2)V形 直线形 SO2 因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
(3)Cr 四 1s22s22p63s23p63d54s1 +6
(4)F―H…F F―H…O O―H…F O―H…O
解析:由“X原子核外的M层中只有两对成对电子”则X为硫元素。“Y原子核外的L层电子数是K层的两倍”则Y为碳元素。“Z是地壳内含量最高的元素”则Z为氧元素。“Q的核电荷数是X与Z的核电荷数之和”则Q为铬元素,其元素符号为Cr,位于元素周期表的第四周期,其核外电子排布式为:1s22s22p63s23p63d54s1,在形成化合物时其最高化合价为+6。“E在元素周期表的各元素中电负性最大”即E为氟(F)元素,在E的氢化物(HF)溶液中存在的所有氢键为:F―H…O、O―H…F、O―H…O。XZ2与YZ2分别为SO2和CO2分子,其立体结构分别为V形(角形)和直线形,在相同条件下二者在水中溶解度较大的是SO2,原因是CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中溶解度较大。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
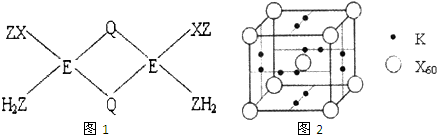 已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满.请回答下列问题:
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com