
| A. | C3H8 | B. | C2H6 | C. | C2H4 | D. | C6H6 |
分析 设烃的分子式为CxHy,根据CxHy+(x+$\frac{y}{4}$)O2→xCO2+$\frac{y}{2}$H2O利用差量法计算出氢原子的数目,再根据完全燃烧即氧气足量进行解答.
解答 解:设烃的分子式为CxHy,则:
CxHy+(x+$\frac{y}{4}$)O2→xCO2+$\frac{y}{2}$H2O△V
1 x+$\frac{y}{4}$ x 1+$\frac{y}{4}$
10mL 10mL+50mL-35mL=25mL
则1:( 1+$\frac{y}{4}$)=10mL:25mL,解得y=6,
烃完全燃烧,故10mL×(x+$\frac{6}{4}$)≤50mL,则x≤3.5,
故该烃的分子式为C2H6或C3H6,
故选B.
点评 本题考查有机物分子式确定的计算,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,注意掌握确定常见有机物分子式的方法,明确差量法在确定有机物分子式中的应用方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
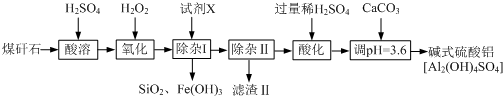
 为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成份SO2)来制取石膏(CaSO4•2H2O)和过二硫酸钠(Na2S2O8).设计简要流程如下:
为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成份SO2)来制取石膏(CaSO4•2H2O)和过二硫酸钠(Na2S2O8).设计简要流程如下: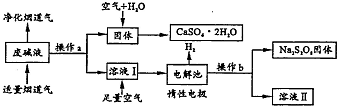
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
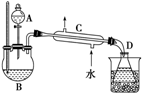 乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34,.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2-O-CH2CH3(乙醚)+H2O
乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34,.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2-O-CH2CH3(乙醚)+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
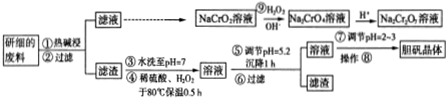
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 2.9 | 6.7 | 9.4 | 9.7 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H5OH | C. | CH3CHO | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、蛋白质、油脂均是天然高分子化合物 | |
| B. | 铜矿石在细菌作用下可直接转化为单质铜,这个过程叫生物炼铜 | |
| C. | 氟氯烃的肆意排放会加速臭氧层的破坏,使大气层中的紫外线增强 | |
| D. | 凯库勒的“基团理论”尽管存在缺陷,但仍对有机化学的发展起到了巨大的推动作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
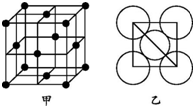 铜、铁、铝都是日常生活中常见的金属,具有广泛用途.请回答:
铜、铁、铝都是日常生活中常见的金属,具有广泛用途.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
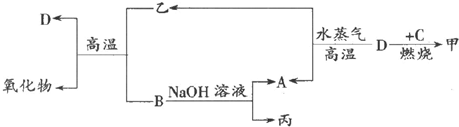
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com