
| A、改变温度 |
| B、恒容,充入N2 |
| C、恒容,充入He气 |
| D、恒压,充入He气 |


科目:高中化学 来源: 题型:
| 编号 | 操作 | 现象 |
| Ⅰ |  | 反应剧烈,试管中的黑色固体逐渐溶解,产生大量的无色具有臭鸡蛋气味的气体. |
| Ⅱ | 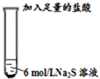 | 只有少量的无色臭鸡蛋气味的气体产生,但溶液中却有一定量的淡黄色沉淀产生. |
| 编号 | 操作 | 现象 |
| Ⅲ | 将H2S通入蒸馏水中达到饱和,将该溶液分为两等份.一份静置,另一份在空气中不断振荡. | 两份溶液在短时间内均未出现明显的浑浊现象. |
| 编号 | 操作 | 现象 |
| Ⅳ | 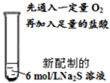 | 先通入一定量O2,几乎看不到明显变化;加入足量的盐酸,产生无色具有臭鸡蛋气味的气体,溶液中有大量的淡黄色沉淀产生. |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl |
| B、NaOH |
| C、MgSO4 |
| D、NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、T℃时,饱和CaCO3溶液与饱和CaF2溶液相比,后者Ca2+浓度大 |
| B、T℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合,会析出CaCO3固体 |
| C、T℃时,CaF2固体在20mL0.01 mol?L-1盐酸中的Ksp比在纯水中的Ksp大 |
| D、T℃时,在CaCO3悬浊液中加入NaF固体,CaCO3不可能转化为CaF2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 有关性质或结构信息 |
| A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B | B原子得到一个电子后3p轨道全充满 |
| C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体 |
| E | E元素的核电荷数等于A原子核B元素氢化物的核电荷数之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑦ | B、③⑤ |
| C、②④⑤ | D、①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com