
| A、24 | B、40 | C、56 | D、65 |
| 50g×18.25% |
| 36.5g?mol-1 |
| 3.5g |
| 0.125mol |
| 2.5g |
| 0.125mol |


科目:高中化学 来源: 题型:
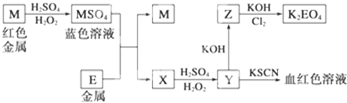
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×10-4 | 2 | 1.9×10-5 |
| A、上述反应是熵增反应 |
| B、在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol?L-1,则此时v(正)<v(逆) |
| C、25℃时,反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数是0.5 |
| D、恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO的百分含量将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠溶液与过量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| B、向溴化亚铁溶液中通入过量氯气:Fe2++2Br-+2Cl2=Fe3++Br2+4Cl- |
| C、1 mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
| D、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、XY |
| B、XY2 |
| C、XY3 |
| D、XY4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、常温下,1mol丁香酚只能与2mol Br2反应 |
| B、丁香酚不能与FeCl3溶液发生显色反应 |
| C、1mol香兰素最多能与3mol氢气发生加成反应 |
| D、香兰素分子中至少有12个原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A、将容器体积变为原来2倍,CO的平衡浓度变为原来的2倍 | |||
| B、恒温恒容下,增大压强,H2浓度一定减小 | |||
| C、升高温度,逆反应速率减小 | |||
D、该反应化学方程式为CO2+H2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,7.1g Cl2和足量的NaOH反应,转移电子数0.2NA |
| B、标准状况下,11.2L氩气含原子数NA |
| C、32g O2和O3混合气体含氧原子数2NA |
| D、18g H2O和18g D2O所含电子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com