
化工生产中常用 FeS 作沉淀剂除去工业废水中的 Cu2+:Cu2+(aq)+FeS(s) CuS(s)+Fe2+(aq) ,下列有关叙述中正确的是
CuS(s)+Fe2+(aq) ,下列有关叙述中正确的是
A.FeS的Ksp小于CuS的Ksp
B.达到平衡时c (Fe2+)=c (Cu2+)
C.溶液中加入少量 Na2S固体后,溶液中c (Cu2+)、 c (Fe2+)都减小
D.该反应平衡常数 K =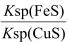
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源:2015-2016学年四川省高一下期中化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
B.第ⅥA族元素中,气态氢化物稳定性最好的其单质氧化性也最强
C.同周期非金属氧化物对应水化物的酸性从左到右依次增强
D.第二周期元素的最高化合价为+1→+7
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:计算题
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)  M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
请计算:
(1)实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N);
(2)实验②中,该反应的平衡常数K ;
(3)实验③中,达到平衡时,X的转化率 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:选择题
同学们使用的涂改液中含有很多有害的挥发性物质,二氯甲烷就是其中的一种,吸入会引起慢性中毒,有关二氯甲烷的说法正确的是 ( )
A.含有非极性共价键 B.键角均为 109°28′
C.有两种同分异构体 D.分子属于极性分子
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三第九次月考化学试卷(解析版) 题型:填空题
短周期元素 W、X、Y、Z 在元素周期表中的位置如右图所示。其中 Z 的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
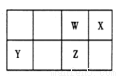
(1)W 在元素周期表中的位置是____________。
(2)W、X、氢元素形成的三原子分子的电子式____________。
(3)下列选项中,能证明元素非金属性X强于W的是____________。
A.相对原子质量:X>W B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与 Z 同周期的某金属元素形成的单质 A,可发生如下图所示的转化:
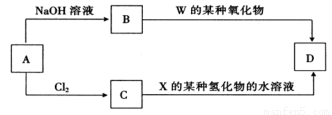
其中化合物D是一种白色沉淀,则 B 中溶质的化学式为____________;
B与 C也可直接转化生成 D 写出对应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三第九次月考化学试卷(解析版) 题型:选择题
下列颜色变化与氧化还原反应无关的是
A.将乙醛加入新制氢氧化铜中加热,出现砖红色沉淀
B.将乙醇滴入酸性重铬酸钾溶液中,溶液由橙色变为绿色
C.将二氧化硫通入滴有酚酞的氢氧化钠溶液中,溶液红色褪去
D.新制氯水敞口久置,颜色褪去
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟九化学试卷(解析版) 题型:选择题
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.基态原子的4S能级中只有1个电子的元素共有4种
B. 得电子能力不相同
得电子能力不相同
C.Cl-、S2-、Na+、K+半径逐渐减小
D.最外层有3个未成对电子的原子一定属于主族元素
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟九化学试卷(解析版) 题型:选择题
下列关于元素及其化合物的说法正确的是
A.Fe 在常温下可与浓硝酸、稀硝酸、浓硫酸剧烈反应
B.Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用相同
C.Na久置于空气中,可以与空气中的有关物质发生反应,最终生成Na2CO3粉末
D.制备FeCl3、CuCl2固体均可采用将溶液直接蒸干的方法
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三5月月考理综化学试卷(解析版) 题型:实验题
钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
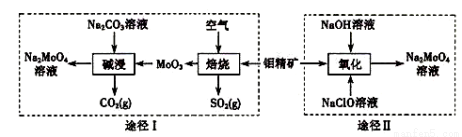
(1) NaClO的电子式是 。
(2)为了提高焙烧效率,除增大空气量外还可以采用的措施是 。
(3)途径I碱浸时发生反应的化学反应方程式为 。
(4)途径Ⅱ氧化时发生反应的离子方程式为 。
(5)分析纯的钼酸钠常用四钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是 。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:
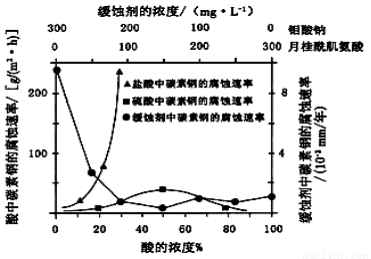
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为__ __。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 。
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com